Kemi
Omsmotisk tryk
Blodets osmotiske truk er målt til 775 kPa ved 310 K.
Beregn hvor mange gram glucose (C6H12O6) der skal opløses i vand, for at opløsningen efter fortynding til 1,000 liter får samme osmotiske tryk ved 310 K som blod.
Håber der er en venlig sjæl der kan hjælpe med denne opgave.
På forhånd tak.
Svar #1
02. februar 2012 af mathon
π = (R·T)·ck (ck = kolligativ koncentration)
ck = π / (R·T) (π = osmotisk tryk)
ck = (7,75·105 Pa) / ((8,31451 Pa·m3/(mol·K))·(310 K)) = 300,679 mol/m3 = 0,3007 M
dvs
en glucose-koncentration på 0,3007 mol pr liter
m / V = n·M / V = (0,3007 mol)·(180,16 g/mol) / (1 L) = 54,17 g/L
Blodets osmotiske tryk 775 kPa ved 310 K
ækvivalerer
54,17 g glucose pr. liter vand
Svar #2
02. februar 2012 af Marimekko (Slettet)
Tusinde tak for hjælpen!
Skal nu beregne, ved hvilken temperatur blod fryser?! (Man går her ud fra, at molaritet=molalitet.
Har prøvet en masse ting, men kan ikke få det til at lykkedes. Måske du kan give en hjælpende hånd. Svaret skal blive -56 celcius.
Svar #3
02. februar 2012 af mathon
frysepunktsænkning nor opløsningsmidlet er vand
ΔTF = (1,86 K·L/mol) · ck når molaritet regnes lig molalitet
ΔTF = (1,86 K·L/mol) · (0,3007 mol/L) = 0,56 K = 0,56 C
opløsningens frysepunkt er således
0 - 0,56 C = - 0,56 C
Svar #4
26. januar 2015 af LLLLLLLLLLLLLLLL
Beregn hvor mange g NaCl, der skal opløses i vand, for at opløsningen efter fortyndng til 1,000 liter får samme osmotiske tryk (775 kPa) ved 310 K som blod
Svar #5
26. januar 2015 af mathon
Det osmotiske tryk 7,75·105 Pa ækvivalerer 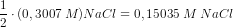
Blodets osmotiske tryk 775 kPa ved 310 K
ækvivalerer
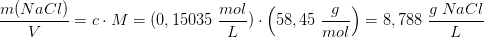
Svar #6
26. januar 2015 af LLLLLLLLLLLLLLLL
du multiplicerer med 1/2, fordi ck er lig summen af osmolaliteterne af de opløste stoffer? Hvis vi kalder antallet af opløste stoffer for q, så er q for C6H12O6 lig 1 og q for NaCl lig 2. Korrekt?
Skriv et svar til: Omsmotisk tryk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







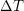 er det samme i Kelvin-grader som i Celsius-grader.
er det samme i Kelvin-grader som i Celsius-grader.