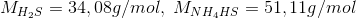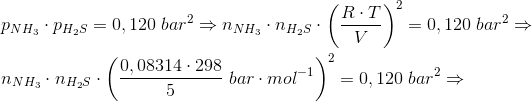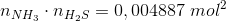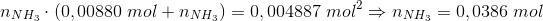Kemi
Kemisk ligevægt
Ved 298 K har ligevægtskonstanten K værdien 0,120 bar^2 for nedenstående reaktion:
NH4HS(s) (harpuner) NH3(g) + H2S(g)
0,300 g H2S anbringes i en tom beholder på 5,00 L ved 298 K, der tilsættes fast NH4HS indtil der netop har indstillet sig en ligevægt
Beregn den mindste masse NH4HS der skal tilsættes for netop at opnå ligevægt
Nogen der kan hjælpe mig med at løse denn besværlige opgave?
Takker :)
Svar #1
08. januar 2004 af iB (Slettet)
(jeg håber en keminørd måske kan svare bedre ;-))
Svar #2
10. januar 2004 af Belief (Slettet)
Jeg forstår ikke helt hvad du mener. Kunne nogen være så venlig at uddybe det? Please :)
Svar #3
11. januar 2004 af Belief (Slettet)
Please hjælp! Opgaven skal afleveres i morgen.
Svar #4
11. januar 2004 af Belief (Slettet)
Please hjælp! Opgaven skal afleveres i morgen.
Tusind tak ;)
Svar #5
11. januar 2004 af Belief (Slettet)
Skriv et svar til: Kemisk ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.