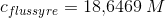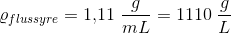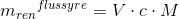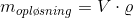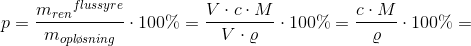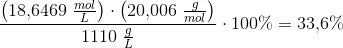Kemi
Kemi oxidere reducere ..beregn masse
Svar #7
04. juni 2014 af mathon
stofmængdeforholdet:
Nb2O5 : Al = 3 : 12 = 1 : 4
M(Nb2O5) = sum({2,5}*{92.906,15.999}) g/mol = 265,807 g/mol
M(Al) = 26,982 g/mol
masseforholdet:
Nb2O5 : Al = 265,807 : 4·26,982 = 1 : 0,406039
massen af Al, der skal forbruges til reaktion
med 33 ton niobit:
m(Al) = (33 ton) · 0,406039 = 13,4 ton
Svar #8
04. juni 2014 af dnopas (Slettet)
Tror ikke bare du kan blande enhederne fra det periodiske system sammen med vægtenheden, koefficienten er 1:4, og Niobit = Nb2O5 = 33 ton, så når der er 33 ton af niobit må der være 4 gange så meget aluminium
Svar #9
04. juni 2014 af mathon
#8
Dit udsagn er ikke korrekt.
Masseforholdet er ikke lig med molforholdet.
Svar #10
04. juni 2014 af mathon
Sammenhængen mellem en  -molær opløsning med densiteten
-molær opløsning med densiteten 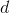 af et stof med molmassen
af et stof med molmassen 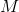
og stoffets masseprocent 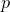
er:
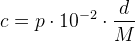
hvoraf
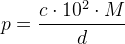
fortyndingsfaktor 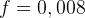
Svar #11
05. juni 2014 af mathon
Beregning af masseprocenten af flussyre:
titreringen giver:
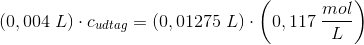
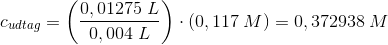
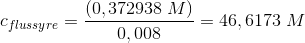
masseprocent:
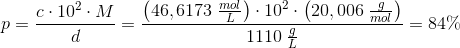
Svar #12
05. juni 2014 af Heptan
#11 Nej
Hvis masseprocenten er 84 % er der mere flussyre end der er vand, som endda er tungere end flussyre?
For det første bliver der anvendt 10,00 mL og ikke 4 mL til titreringen, og for det andet er opløsningen fortyndet.
Således er stofmængden af flussyre i titreringen:

Da titranden havde rumfanget 10 mL, men kom fra en opløsning med rumfanget 50 mL, er stofmængden af flussyre 5 gange større i det oprindelige "udtag":

Koncentrationen af flussyre er altså, idet prøven havde rumfanget 4,00 mL:

Koncentrationen omregnes til g/mL:

og masseprocenten beregnes ud fra densiteten af opløsningen, som er 1,11 g/mL:

Svar #13
05. juni 2014 af mathon
#12
du har ret i, at der skal korrigeres til
Beregning af masseprocenten af flussyre:
titreringen giver:
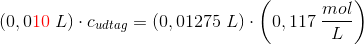
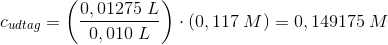
men fortyndingen er nu fra 0,4 mL til 50 mL
dvs med koncentrationsfaktor 1/125 = 0,008
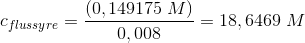
masseprocent:
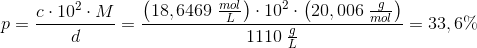
Svar #14
23. september 2014 af fasolka (Slettet)
#7
Kan du forklare fra trin til trin hvad du gør med beregnigner og hvorfor du gør det?
Svar #15
24. september 2014 af Heptan
#14
Aluminium og niobit reagerer jf. reaktionsskemaet. Vi får at vide at 33 ton niobit reagerer. Niobit vejer ikke det samme som aluminium, så vi er nødt til at bruge stofmængder til at beregne hvor meget aluminium der skal til for at omdanne 33 ton niobit, da de reagerer i stofmængdeforholdet 3:12 (som er koefficienterne i reaktionsskemaet).
Massen af niobit (33 ton) kan vi omregne til en stofmængde med formlen n = m/M
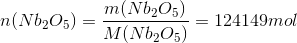
Da forholdet var 3:12 betyder det, at der skal være 4 gange så mange aluminiumatomer som der er niobit-forbindelser.
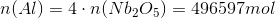
Ved hjælp af formlen m = n * M kan massen af denne stofmængde beregnes:
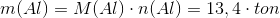
Der forbruges altså 13,4 ton aluminium ved reaktion med 33 ton niobit. Det er ikke underligt at massen af aluminium der forbruges er meget mindre end for niobit, selvom der er flere aluminiumatomer. Aluminium har jo en meget lavere formelmasse end niobit.
Svar #16
24. september 2014 af fasolka (Slettet)
#15 Mange mange tak! :D
Kunne du også forklare #13?
Svar #18
25. september 2014 af Heptan
cudtag er den formelle stofmængdekoncentration af "den fortyndede opløsning", dvs. titranden (den opløsningen der titreres med NaOH).
Svar #19
01. marts 2015 af NicolasJonsson (Slettet)
#11 og #12
Er der nogle der kan uddybe hvordan i beregner masseprocenten af flussyre? Jeg kan ikke se #11 og jeg tror ikke jeg forstår det helt #12...
Er der eventuelt en der har mulighed for at uddybe #12? Eller i det mindste hjælpe mig til at kunne se #11 - der er bare blå spørgsmålstegn der hvor formlerne burde være.
På forhånd mange tak :)