Kemi
Iodid og iodat
Hej!
Er der måske en der kan forklare mig den vedhæftede opgave?
Reaktionsskemaet er:
3 I_2 (s) + 6 KOH (aq) ---> 5 KI (aq) + KIO_3 (aq) + 3 H_2O (l)
På forhånd tusind tak!
Svar #2
23. august 2014 af Soeffi
Du kan vel ikke lægge et foto af hele opgaven op? (Jeg savner nogle mængdeangivelser.)
Svar #3
23. august 2014 af Julie3125
Undskyld det tænkte jeg ikke på :) Her kommer resten
Svar #4
23. august 2014 af Soeffi
Svar a) oxidationstal for I i I2 = 0, ox(I) i KI = -1 og ox(I) i KIO3 = 5.
Svar b) For at svare på b skal man vide, hvor mange mol, der er af hver reaktant (I2 og KOH). Dernæst skal man finde ud af om en af stofferne begrænser mængden af stof, som kan reagere. Der gælder ud fra reaktionsligningen at et I2 skal have 2 KOH ved fuldstændig reaktion.
Man finder antal mol for I2 som (massen af I2)/(molmassen as I2) = 50,9g/253,80g·mol-1 = 0,2005 mol
Antal KOH er tilsvarende lig 22,5g/56,911g·mol-1 = 0,3954 mol.
Her begrænses mængden af stof, som kan reagere af antal mol KOH, da dette er mindre end 2 gange antallet af mol I2. Dvs. alt KOH vil reagere, mens der vil blive en smule I2 til overs.
Ud fra reaktionsligningen får man, at antal mol KI, som dannes er 5/6 gange antal mol KOH eller 0,3295 mol. Antal mol KIO3 som dannes er 1/6 gange antal mol KOH eller 0,0659 mol.
Massen af KI er antal mol KI gange molmassen af KI eller 0,3295mol·166,002g·mol-1 = 54,70 g.
Massen af KIO3 findes tilsvarende til 0,0659 mol·213,999g·mol-1 = 14,10 g.
Molmasserne findes som
molmasse (I2) = 2 gange molmassen af I
molmasse af KOH = molmasse af K + molmasse af O + molmasse af H
molmasse af KI = molmasse af K + molmasse af I
molmasse af KIO3 = molmasse af K + molmasse af I + 3 gange molmassenaf O
molmassen af vand er 18 g pr mol, men ikke nødvendig for at løse opgaven
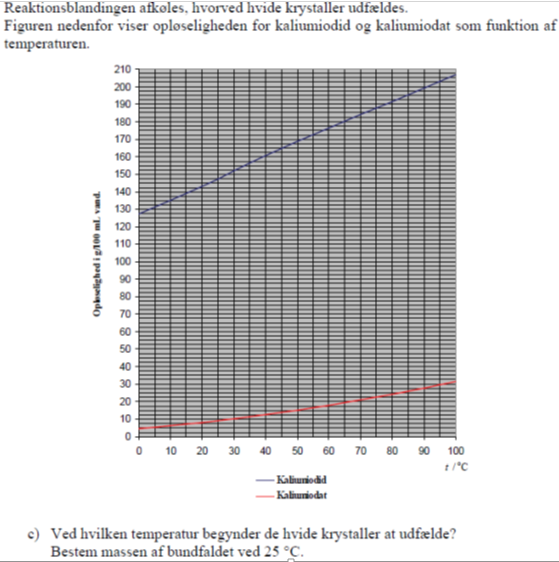
Svar c) Mængden af vand er fra starten 100 mL, hertil dannes ca. 4 g vand ved reaktionen, som man for nemheds skyld ser bort fra.
Kurverne viser hvor mange gram KI og KIO3 , der kan opløses i 100 mL vand ved forskellige temperaturer. Man har ca. 54 g KI. Af figuren ses at disse 54 g er opløselige ved alle temperaturer, da den mænge KI der kan opløses i 100 mL vand altid er større end 128g.
Der er dannet 14 g KIO3. Det ses af figuren at er temperaturen under 50 grader kan der opløses mindre end 14 g så udkrystallisation begynder ved denne temperatur.
Ved 25 grader celcius er 9 gram KIO3 i opløsning, dvs 14 minus 9 gram eller 5 gram er udfældet.
Skriv et svar til: Iodid og iodat
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.