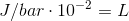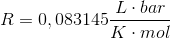Kemi
Idealgasloven opgave
Hvordan skal jeg bære mig ad med at løse følgende opgave?
Opskriv idealgasloven og anvend denne til fx at beregne voluminet af 2 mol O2(g) med et tryk på 1,0 bar ved en temperatur på 100 °C.
Tak på forhånd.
Svar #1
30. august 2014 af peter lind
Idealgasloven P*V = n*R*T P trykket, V rumfanget, n antal mol, R er gaskonstanten og T er temperaturen i grad Kelvin
Svar #2
30. august 2014 af Jansiii (Slettet)
Tak. Er dette korrekt udregnet så:
V = n*R*T/P
V = 2 mol * 8,31 Joules/mol Kelvin *100 + 273,15 Kelvin / 1,0 = 1935,15
Svar #3
30. august 2014 af peter lind
Du skal have '(100+273,15) Kelvin.
Du skal omregne bar til SI systemet
Du mangler enheder på rumfanget
Svar #6
31. august 2014 af Jansiiii (Slettet)
Mange tak :-).
Er dette korrekt så:
V = 2 mol * 0,083145 L*bar/K*mol * (100 + 273,15) Kelvin / 1,0 bar = 62,0511135 m^3
Skriv et svar til: Idealgasloven opgave
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.