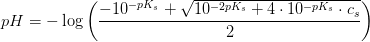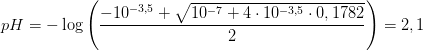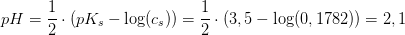Kemi
syre-basekemi
Hej, er der nogle, som vil hjælpe mig igang med denne opgave? :)
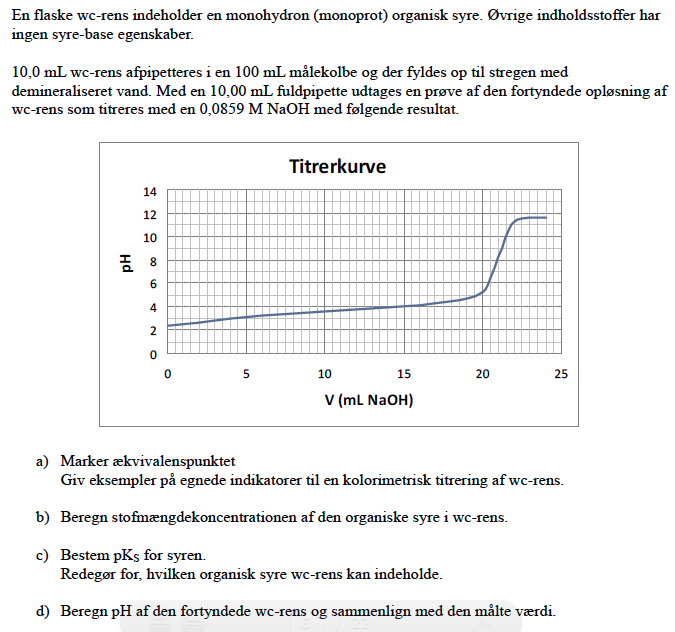
I a'eren kan man så finde ækvivsærnspunktet ved blot en aflæsning af kurven eller kan man også gøre det vha. af beregninger?
Svar #2
01. september 2014 af mathon
OK
pKs kan aflæses som den til halv titratorvolumen korresponderende pH-værdi.
Svar #3
02. september 2014 af Sneharusha (Slettet)
a'eren: I denne del skal man så ikke blot nøjes med at aflæse? Hvis ækvivalenspunktet er der, hvor man har vendetangent, er ækvivalenspunktet ved 22 ml. Er det ikke rigtigt?
Svar #4
02. september 2014 af Heptan
Hvad står der i opgaven? Der står marker ækvivalenspunktet, og giv eksempler på egnede indikatorer ... så du er halvt færdig nu.
Læg mærke til hvad pH er ved ækvivalenspunktet
Svar #5
02. september 2014 af Sneharusha (Slettet)
Arhh okay så, at jeg skal sige at ækvivalenspunktet er 22 ml ved en pH på 8.
En god indikator kan vel være thymolblåt (1,65) lakmus, kresolrødt og thymolblåt (8,9).

Svar #6
04. september 2014 af Sneharusha (Slettet)
Er der nogle, som gerne vil hjælpe mig med d'eren? :)
Svar #7
04. september 2014 af mathon
d)
De 10 mL syre i fuldpipettet indeholder
n(syre) = n(NaOH) = (0,02075 L) · (0,0859 mol/L) = 0,001782 mol
dvs med den formelle koncentration
c(syre) = n/V = ( 0,001782 mol) / (0,010 L) = 0,1782 M
Ved pH-beregning efter formlen for en svag syre
har du
pH = (1/2)·(pKs - log(cs))
Svar #9
07. september 2014 af Sneharusha (Slettet)
#2 Kan jeg spørge, hvordan du ved at: pKs kan aflæses som den til halv titratorvolumen korresponderende pH-værdi.
Svar #10
07. september 2014 af mathon
Når titreringen er påbegyndt men endnu ikke færdig
har du for pufferen, når Vo er titratorvolumenet
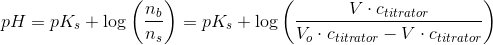
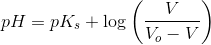
som for
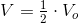
giver
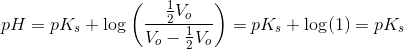
Svar #11
07. september 2014 af Sneharusha (Slettet)
Vo er titratorvolumnet. Er V volumnet for titranden?
Svar #13
08. september 2014 af Sneharusha (Slettet)
ved b'eren kan jeg se at du har sagt at koncentrationen er 0,1782 M, men får det til 1,782 M, da jeg har ganget det med fortyndingsfaktoren 10. Er det forkert?
Svar #14
08. september 2014 af Sneharusha (Slettet)
Ved #7 siger bruger du formlen for en svag syre, men når pks er omkring 3,5 er den vel middelstærk.
Skriv et svar til: syre-basekemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.