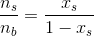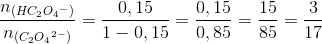Kemi
Syre-Basetitrering
Hej!
Jeg har svært ved følgende opgaver:
Der afvejes 202 mg af stoffet. Det opløses i vand og titreres med NaOH-opløsningen. Analysen viser at stoffet foruden kaliumhydrogenoxalat indeholder 8,7 masseprocent oxalsyre.
1) hvor mange mL NaOH-opløsning blev der brugt ved titreringen?
opgave 2 er vedhæftet:
2) bestem stofmængderne af oxalsyre, hydrogenoxalation og oxalation i ovennævnte titreringsblanding når pH for blandingen er 5,0. (se vedhæftede billede)
tak på forhånd! :D
Svar #1
02. september 2014 af mathon
n(H2C2O4) = (m/M) = (0,202 g) · 0,087 / (90,034 g/mol) = 0,000195 mol
n(KHC2O4) = (m/M) = (0,202 g) · (1 - 0,087) / (128,124 g/mol) = 0,001439 mol
neutralisation af 0,000195 mol H2C2O4 kræver 2 · (0,000195 mol) OH- = 0,000390 mol OH-
neutralisation af 0,001439 mol KHC2O4 kræver 0,001439 mol OH-
samlet forbrug af NaOH = (0,000390 + 0,001439) mol = 0,001829 mol
V(NaOH) = (0,001829 mol) / c(NaOH)
Svar #3
02. september 2014 af erinaa (Slettet)
#2Ved pH = 5
er
n(H2C2OO4) = 0n(HC2OO4-) = 15%
n(C2OO42-) = 85%
Tak :D men hvordan ser du det?
Svar #6
03. september 2014 af mathon
korrektion af tastefejl i #2
Ved pH = 5
er
n(H2C2O4) = 0
n(HC2O4-) = 15%
n(C2O42-) = 85%
Svar #7
03. september 2014 af Soeffi
Kan man ikke aflæse procenterne direkte?
Svar #10
04. september 2014 af Soeffi
erinaa, du mangler koncentrationen af NaOH for at kunne besvare a). Upload venligst hele opgaven.
Svar #11
04. september 2014 af Soeffi
1) Jeg går ud fra at n(NaOH) er lig 0,000195 mol, da man titrerer H2C2O4 til HC2O4- for at finde mængden af H2C2O4.
2) Man skal finde stofmængderne dvs.
n(H2C2O4) = 0 (aflæses)
n(HC2O4-) = 15%·0,001634 mol (den første aflæses og den anden er summen af n(H2C2O4) og n(HC2O4-) fra starten beregnet i 1) = 0,000245 mol
n(C2O42-) = 85%·0,001634 mol = 0,001389 mol
Skriv et svar til: Syre-Basetitrering
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.