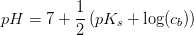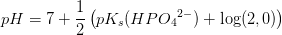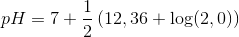Kemi
HJÆLP - kemi opgaver
Hej, jeg har virkelig brugt lang tid på den her opgave, men kan ikke forstå den og komme videre.
Jeg har lavet alle øvrige delopgaver, men det er den eneste jeg ikke rigtigt forstår.
Delopgaven lyder:
e) Beregn pH for en 2,0 M opløsning af .
Det kan antages, at phosphat opfører sig som en monohydron base.
tak på forhånd.
Svar #3
16. september 2014 af Heptan
Phosphat er en svag base, som reagerer med vand efter følgende reaktionsskema:
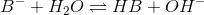
Den formelle koncentration af den svage base kan med god tilnærmelse udtrykkes som:
![c_b=[HB]+[B^-]\approx [B^-]](https://media.studieportalen.dk/images/equations/XmUv1qX5maNlcIb4tjwByQ==.gif)
Der gælder desuden følgende sammenhæng:
![[H_3O^+]=[B^-]+[OH^-]](https://media.studieportalen.dk/images/equations/4bZ-HuOKiJ6Ncg-6c8cKLA==.gif)
[B-] kan med god tilnærmelse udtrykkes således:
![[B^-]=[H_3O^+]-[OH^-]\approx [H_3O^+]](https://media.studieportalen.dk/images/equations/a-CPMdorSpPGjHc8hQwumw==.gif)
Heraf kan ligevægtsloven for ligevægten opskrives:
![K_b=\frac{[HB][OH^-]}{[B^-]}=\frac{(\frac{10^-^1^4}{[H_3O^+]})^2}{c_b}](https://media.studieportalen.dk/images/equations/M238WX-EDSMp3_sWeN2h-A==.gif)
![\Leftrightarrow pK_b=-log(\frac{(\frac{10^-^1^4}{[H_3O^+]})^2}{c_b})](https://media.studieportalen.dk/images/equations/zsMD3m_IZiXIClrA42ptNw==.gif)
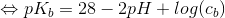
Isolér pH og indsæt pKb = 14 - pKs
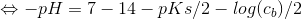
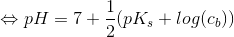
Skriv et svar til: HJÆLP - kemi opgaver
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.