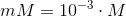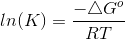Kemi
Beregn deltaG° for reaktion III ud fra deltaG°(I) og deltaG°(II)
Som overskriften siger, så skal jeg beregne
deltaG° for reaktion III ud fra deltalG°(I) og deltaG°(II)
Hvordan kan jeg beregne den. Jeg kender deltaG°(I) og (ll)
Svar #1
19. september 2014 af Heptan
Må vi se reaktionerne?
Hvis reaktion III er summen af reaktion I og reaktion II, skal du simpelthen lægge de to deltaG0 værdier sammen, da gibbs energi er en tilstandsfunktion.
Svar #2
19. september 2014 af UK343
(l) ADP + PO4-3 --> ATP + H2O , deltaG° = 30,6kJ/mol og deltaH°=20,5kJ/mol ved 310 K
(ll) glukose + PO4-3 --> glukose-6-phosphat + H20 , deltaG° = 14,0kJ/mol ved 310 K
(lll) ATP + glukose --> ADP + glukose-6-phosphat
Svar #3
19. september 2014 af Heptan
Af reaktionsskemaerne ses, at reaktion (III) simpelthen er reaktion (I) trukket fra reaktion (II).
Du kan altså finde deltaGo ved at trække deltaGo for reaktion (I) fra reaktion (II)
Svar #4
20. september 2014 af UK343
Så jeg siger rektion (l) - reaktion (ll) ?
Svar #5
20. september 2014 af UK343
Da de fysiologiske koncentrationer af ATP, ADP og PO4-3 ikke er 1 M, er den energi, der kræves for at syntetisere ATP under fysiologisk betingelser forskellig fra G°(I). I en celle vil man typisk have følgende koncentrationer af stoffer [ATP] = 3,4 mM, [ADP] = 1,4 mM og [PO4-3] = 5,0 mM.
d) Beregn G ved 310 K for reaktion I under disse betingelser.
Ved du hvordan man kan regne denne, når der er i mM
Svar #6
20. september 2014 af UK343
Kender denne formel:
deltaG=deltaGO+RTln([PO4-3][ADP]/[ATP]
skal man lave om på enhed mM?
Svar #11
21. september 2014 af flopper (Slettet)
Hvis man skal beregne ligevægtskonstanten for reaktion III, hvor er det så lige for en formel man skal bruge?
Jeg har kigget på formlen lnKp=(-ΔrGo)/(RT). Kan man bruge den og så bare sige at kg=Kc, da der ikke er nogle koefficinter på reaktionen. Og kan man bare sige at ΔGo = ΔrGo
Skriv et svar til: Beregn deltaG° for reaktion III ud fra deltaG°(I) og deltaG°(II)
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








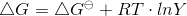
![Y=\frac{[ATP]}{[ADP][PO_4^3^-]}](https://media.studieportalen.dk/images/equations/3_kQeSu-xONt1B_jsqmQeA==.gif)