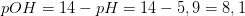Kemi
syre
Hej SP.
Jeg skal
1. opskrive molekyleformlen for aspargussyre - Billedet er vedhæftet
Men er dette rigtigt: S5COOH
2. forklare ud fra strukturen, hvorfor aspargussyre kan udskilles i urinen
3. Hvis pH i urinen er 5,9 ,hvad er [OH-] og [H3O+]
Tak på forhånd.
Svar #2
18. oktober 2014 af Heptan
2. Aspargussyre er en carboxylsyre, så den reagerer med vand i en syre/base reaktion, og derfor er den letopløselig i vand
3.
![[H_3O^+]=10^{-pH}=10^{-5,9}](https://media.studieportalen.dk/images/equations/lPKnCM5rghG8NFRdJfFn3w==.gif)
For at beregne [OH-]: Ved 25 Co er vands ionprodukt, Kv = 10-14 M:
![\newline 10^{-14}\ \textup{M}=[OH^-]\cdot [H_3O^+] \newline \newline [OH^-]=\frac{10^{-14}}{[H_3O^+]}](https://media.studieportalen.dk/images/equations/uCVzti7p_9_Nsi8EXEuEvg==.gif)
Svar #4
18. oktober 2014 af SSunshine (Slettet)
Hvorfor er [H3O+]=105.9 - altså den samme pH som i urinen?
og er aspargussyre svag syre?
Svar #5
18. oktober 2014 af Heptan
pH beregnes som
![pH=-\log [H_3O^+]](https://media.studieportalen.dk/images/equations/raU1G4DtNWW_yDAmpd7Esw==.gif)
... som kan omskrive til
![[H_3O^+]=10^{-pH}](https://media.studieportalen.dk/images/equations/Ecfx8uXCiZfyU-D9oQjvOQ==.gif)
____________________________________
Aspargussyre har
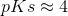
altså på grænsen mellem en middelstærk og en svag syre
Svar #6
18. oktober 2014 af LubDub
#4
[H3O+]=10-5.9
[OH -] = 10 - pOH = 10pH - 14
da
pH + pOH = pKv = 14 ved 25 oC
....... :)
Svar #8
18. oktober 2014 af SSunshine (Slettet)
Er det rigtigt at pH for OH- giver dette: 7.943282346*10-9 M?
Og hvis det er, hvordan kan man så omskrive det så det bliver et "pænere" tal - altså lige at pH for vand er 7.0
Svar #9
18. oktober 2014 af Heptan
#8
Nej det er ikke pH. pH er 5,9.
Det du har beregnet er den aktuelle koncentration af hydroxid i den vandige opløsning, som har pH = 5,9. Jeg får det samme tal som dig når jeg beregner [OH-]
Koncentrationen af hydroxid og oxonium er pH afhængige, og pH er defineret ud fra koncentrationen af oxonium.
Svar #10
18. oktober 2014 af LubDub
#8
pH for OH- er nonsense. Det tal du har fundet er den aktuelle koncentration af OH-.
Hvis du vil finde pOH, så skal du benytte dig af
pH + pOH = 14 ved 25 oC
eller pOH = - log[OH -]
Svar #12
18. oktober 2014 af SSunshine (Slettet)
ok, det er rigtigt, jeg manglede at regne videre.
Tak for hjælpen.
Skriv et svar til: syre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![\left [ OH^{-} \right ]=7,94328\cdot 10^{-9}\; M](https://media.studieportalen.dk/images/equations/BhrzuLcTJ_lywBqGh11qUA==.gif)
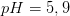
![pOH=-\log(\left [ OH^{-} \right ])=-\log(\left [7,94325 \cdot 10^{-9} \right ])=8,1](https://media.studieportalen.dk/images/equations/zrpSE0oASrvnL9ae9OxbqA==.gif)