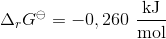Kemi
Bestemmelse af helmholtz energi og gibbs energi ud fra temp og tryk
Hej,
Opgaven er vedhæftet og det drejer sig om opgave C.
Jeg er helt på bar bund mht denne opgave, da den jo ikke indeholder nogen specifikke stoffer..
Jeg ved blot at
delta A = delta U-T*delta S
og
delta G = delta H - T*delta S
Jeg forestiller mig at jeg skal beregne delta U først. Men jeg har ærlig talt inden idé ..
Jeg mangler blot et start hint, hvortil jeg kan komme videre.
Anyone?
Svar #2
19. oktober 2014 af sejereje91
Tusind tak, jeg har ofte problemer med at få det hele til at give mening når jeg kun får et partialtryk forhold :-)!
Når man så skal bestemme Helmholtz energi efter, dette kan man da ikke gøre vha. gibbs energi?
Svar #3
19. oktober 2014 af Heptan
Jeg er kommet i tanke om, at trykket af A nok ikke er dobbelt så stort som B.
Fordi der forbruges jo dobbelt så meget af B.
Hvis fx der forbruges ½ mol A, så er der 1½ mol A tilbage. Men der er 0 mol B tilbage.
Svar #5
19. oktober 2014 af Heptan
Ja, det gør det.
Jeg har tænkt lidt over det, og jeg er kommet frem til følgende ...
Stofmængdeforholdet og partialtrykforholdet er identisk, dvs.
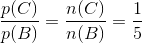
Hvis vi ser bort fra A, så ved vi at der ved start er 1 mol B. I ligevægt er stofmængden af C lig med x og stofmængden af B vil nu være (1 mol - 2x).
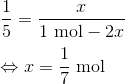
Dvs. at stofmængden af C i ligevægt er 1/7 mol ...
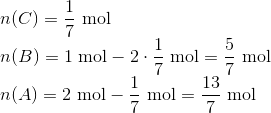
Den samlede stofmængde 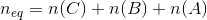 kan nu bruges til at beregne volumen:
kan nu bruges til at beregne volumen:
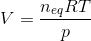
hvor p er det totale tryk ved ligevægt, dvs. 1 bar.
Nu kan omregningsfaktoren mellem stofmængde og partialtryk 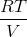 bestemmes, og partialtrykkene kan beregnes én for én ...
bestemmes, og partialtrykkene kan beregnes én for én ...
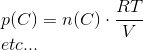
Endelig kan ligevægtskonstanten beregnes:
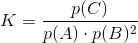
Og Gibbs frie energi kan beregnes:
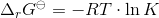
Svar #6
19. oktober 2014 af OliverGlue
Indre energi er konstant for en isoterm proces. Desuden kan entropiændringen for en gas beregnes ved ΔS = nR ln(Vf /Vi) for en isoterm proces, jeg tror mere det er vejen til facit?
Svar #7
19. oktober 2014 af sejereje91
Svar #8
19. oktober 2014 af Heptan
Du kan jo beregne volumen ved
#5
#6 men den er jo konstant, så det giver vel 0 i den formel ... ?
Svar #9
19. oktober 2014 af OliverGlue
#7
I #5 blev volumen beregnet. Siden den indre energi er konstant for en isoterm proces, må ændringen jo være nul og derfor behøves du ikke at kende den. Hvilket kursus er opgaverne fra?
Svar #10
19. oktober 2014 af sejereje91
i facit er den indre energi ikke nul.
Svar #11
19. oktober 2014 af Heptan
Jeg går ikke på universitetet, så jeg kender desværre ikke til det ...
Svar #12
19. oktober 2014 af sejereje91
Hov, det må I undskylde, jeg har ikke noget direkte facit til den indre energi - det er en anden opgave jeg sidder og bøvler med...
Men facit skal være
delta G = -0,393 kJ/mol
delta A = 4,562 kJ / mol
Svar #16
21. oktober 2014 af OliverGlue
#14 Har du omregnet til partialtryk og husket at kvadere B? Jeg får 5.4 ved -(8.134*10^(-3)*298)*ln(C/(A*B))..
#15 Jeg får samme facit. Mit bud er facit er forkert.
En ændring i helmholtz energi er
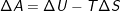
Indsættes udtrykket for gibbs fri energi 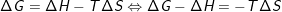 giver det
giver det
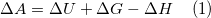
Den indre energi er defineret til
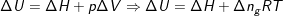
hvor arbejdet kan omskrives vh.a. idealgasligningen. Dette kan indsættes i 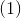
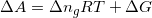
Hvor RT er konstante og ændringen i stofmængde for reaktionen må være 3 -> 1 mol,
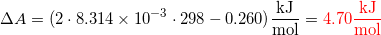
Benyttes den oplyste delta G giver det
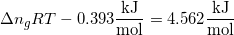
(Der mangler lidt standard states-symboler, men Studieportalen understøtter det vist ikke? Altså \standardsate m. \usepackage{chemstyle} og ikke ominus)
Svar #17
21. oktober 2014 af Heptan
Smaart!
Men hvad angiver g i Δng, og hvorfor siger du den er 2 mol?
Ifølge de beregninger jeg har lavet er den samlede stofmængde ved ligevægt jo 19/7 mol ? Og der dannes 1/7 mol C?
________________________________________
\ominus virker for mig?
Svar #18
21. oktober 2014 af OliverGlue
Δng er ændringen i mol for reaktionen, det er rigtigt den er 21/7-19/7, men ved standardbetingelser skal der opskaleres til 1 mol produkt. Jeg ved ikke hvad g betyder, sikkert gas.. i hvert fald en benyttet notation i denne kontekst.
Ominus virker sikkert, men ikke det samme som \standardstate m. \usepackage{chemstyle}.. men jo bedre end ingenting.
Skriv et svar til: Bestemmelse af helmholtz energi og gibbs energi ud fra temp og tryk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.