Kemi
Opløsning
Håber der er nogle som vil hjælpe mig :)
50,0 Ml 0,00820 M MgCl2 Blandes med 50,0 mL NaOH-opløsning ved 25 grader. Herved udfældes der et bundfald.
A) Opskriv et reaktionsskema for fældningsreaktionen og angiv tilskuerionerne.
Bundfaldet frafiltreres, og den aktuelle koncentration af Mg2+ i filtratet bestemmes til at være 0,00178 M.
B) Beregn den aktuelle koncentration af OH- i filtratet
C) Beregn massen af det udfældede bundfald
D) Beregn den formelle koncentration af den oprindelige NaOH- opløsning
Jeg har prøvet at lave opgaven. Men jeg kommer aldrig frem til relsutatet:( Så håber virkelig i vil hjælpe mig :)
Svar #3
21. oktober 2014 af Heptan
#2 Det skal man selv beregne i D)
B)
Hmm, er det et trickspørgsmål? Magnesiumhydroxid er tungtopløselig, så vi kan antage at al den magnesiumhydroxid der dannes, fælder. Altså er hydroxid den begrænsende faktor, og pH i filtratet er 7.
Svar #4
21. oktober 2014 af KvinderDTU (Slettet)
Men Heptan? Er dette så ikke rigtigt?
B)
Sr^(2+)(aq) + 2Cl^(-)(aq) + 2Na^(+)(aq) + SO4^(2-)(aq) --> SrSO4(s) + 2Na^(+)(aq) + 2Cl^(-)(aq)
50 µmol Sr^(2+)(aq) reagerer med 50 µmol SO4^(2-)(aq),
n_rest(SO4^(2-)(aq)) = (60-50)µmol = 10 µmol
disse 10 µmol SO4^(2-)(aq) befinder sig i et volumen på (25+15)mL = 40 mL
c_rest(SO4^(2-)(aq)) = (10 µmol)/(40 mL) = 0,25 µmol/mL = 0,25 mmol/L =
2,5*10^(-4) mol/L = 2,5*10^(-4) M
Svar #5
21. oktober 2014 af Heptan
C)
Stofmængden af magnesium i MgCl2 opløsningen var:
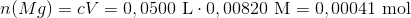
Stofmængden af magnesium, som er tilbage i filtratet er:
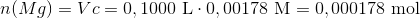
Altså fældes der forskellen i de to stofmængder:
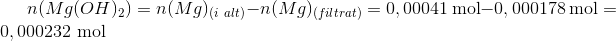
Massen heraf kan let beregnes.
D)
Stofmængden af hydroxid er altså det dobbelte, dvs.
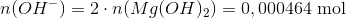
Koncentrationen heraf kan let beregnes.
Skriv et svar til: Opløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.