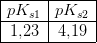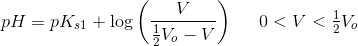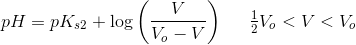Kemi
W/w% kemi
a) Foreslå en egnet indikator til håndtitrering af oxalsyre med natriumhydroxid. Svaret
skal begrundes.
Følgende rådata er fremkommet ved en dobbeltbestemmelse af indholdet af oxalsyre i rabarber
b) Beregn w/w % oxalsyre i rabarberne.
Man ønsker at lave en potentiometrisk titrering af oxalsyre med natriumhydroxid.
Afvejet mængde
Volumen 0,0513 M NaOH forbrugt til titrering af oxalsyre
14,35g 9,71 mL
15,14 g. 10.19 ml
Hvordan beregner man B
Svar #1
24. oktober 2014 af mathon
Hvis håndtering af betyder titrering af (COOH)2 med NaOH,
bør vælges en indikator med
.
pKs2((COOH)2) - 1 < pKindikator < pKs2((COOH)2) + 1
dvs
3,2 < pKindikator < 5,2 hvorfor Congo Rød vil være velegnet.
Svar #2
24. oktober 2014 af smukkedukkee (Slettet)
Hva med opgave b
Hvordan beregner jeg w/w%
Svar #3
24. oktober 2014 af mathon
b)
M((COOH)2) = M(C2H2O4) = sum({2,2,4}*{12.011,1.008,15.999}) g/mol = 90,034 g/mol
Svar #6
24. oktober 2014 af mathon
1. bestemmelse: 
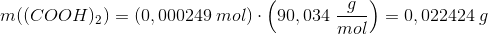
procentisk indhold af (COOH)2:
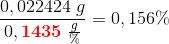
2. bestemmelse:

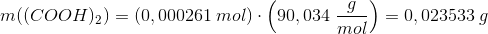
procentisk indhold af (COOH)2:
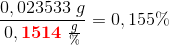
Svar #7
24. oktober 2014 af smukkedukkee (Slettet)
Sidste spørgsmål kan fu forklare mig hvordan man ud fra alle de oplysninger jeg kan lave en titreringakurv har snart eksame og har ik styr pp det
Svar #10
25. oktober 2014 af smukkedukkee (Slettet)
Skriv et svar til: W/w% kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.