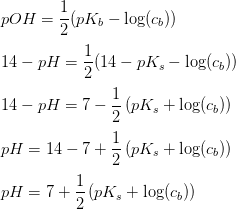Kemi
Titrering
Håber nogle kan hjælpe, da den driller mig rigtig meget.
Der udleveres en ca 1 M prøve af eddikesyre. Fra denne prøve udtages 10,00 mL med en 10,00 mL fuldpipette. Dette volumen overføres til en 100,00 mL målekolbe, og der tilsættes destilleret vand. Der titreres med NaOH.
I skall finde pH i ækvivalenspunktet. I skal her bruge de eksperimentelle data, dvs. den koncentration af eddikesyren, som I har bestemt.
Koncentration er eddikesyre i fortyndingen 0,1027 mol og 1,027 mol inden fortyndingen (Tjekket af lære og er korrekt)
Men hvordan finder jeg pH i ækvivalenspunktet?
Grafisk målt er pH = 9
NaOH = 10,35 mL
Det er noget med at opløsningen er omdannet til base, men bliver ved med at få en pH på 2,8 og det er jo forkert, når den skal give omkring de 9.
Svar #2
25. oktober 2014 af mathon
Titrator og titrand reagerer i stofmængdeforholdet 1 : 1.
n(CH3COO-) = n(CH3COOH) = (0,100 L) · (0,1027 mol/L) = 0,01027 mol
i volumenet (100 + 10,35) mL = 110,35 mL
cb = [CH3COO-] = (0,01027 mol) / (0,11035 L) = 0,093068
pH = 7 + 0,5(pKs + log(cb))
pH = 7 + 0,5(4,75 + log(0,093068)) = 8,859 ≈ 9
Svar #3
25. oktober 2014 af LubDub
Det handler om titrering af en svag syre med en stærk base
Titrerreaktionen
CH3COOH + OH- -----> CH3COO- + H2O
ved ækvivalenspunktet 1 1
og da pKb(CH3COO-) = 9,24 ved 25 oC
er det en svag base,
hvorfor formlen for udregning af pH vist i #2 kan benyttes
Skriv et svar til: Titrering
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.