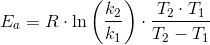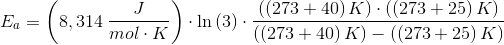Kemi
Arrhenius ligning:
31. oktober 2014 af
christianper (Slettet)
-
Niveau: A-niveau
Hvis hastigheden for en reaktion tredobles når temperaturen stiger fra 25C til 40 C, hvad er så aktiveringsenergien Ea? (R = 8.314 J/mol K).
Skriv et svar til: Arrhenius ligning:
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.