Kemi
Ligevægtsbrøk.
Hej. Nogen som kan hjælpe mig med at opstille en ligevægtsbrøk for denne reaktion: CO_2 (aq) +H_2O (I) --> H2CO^3.
Jeg skal argumentere for om koncentrationen af hydrogencarbonat vil stige hvis der tilføjes carbondioxid.
Svar #1
01. november 2014 af OliverGlue
Ligevægtsbrøken er
![K_{\mathrm{s}}=\dfrac{[\mathrm{H_{2}CO_{3}]}}{[\mathrm{CO_{2}]}}\qquad (1)](https://media.studieportalen.dk/images/equations/n8NbfwjOumNPAoMYhhpHwQ==.gif)
hvor man skal være opmærksom på faste stoffer og solventer(f.eks. vand) ikke indgår i den, pensum. (Vand er medtaget i syren styrkekonstant, http://i.imgur.com/9K2tiyv.png, ikke pensum)
Kulsyre, der dannes ved et høj tryk af CO2 og vand, er en syre, som protonerer vand og danner hydrogencarbonat
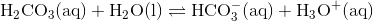
Ligevægtsbrøken er
![K_{\mathrm{s}}=\dfrac{\mathrm{[HCO_{3}^{-}][H_{3}O^{+}]}}{[\mathrm{H_{2}CO_{3}]}}\qquad (2)](https://media.studieportalen.dk/images/equations/yUDvLlFh4dUzbmQsuyHqfA==.gif)
Nu til dit spørgsmål. Med Le Châteliers princip kan du forudsige at dit system vil søge mod ligevægt igen(http://da.wikipedia.org/wiki/Le_Chateliers_princip eller http://en.wikipedia.org/wiki/Le_Chatelier's_principle).
Hvis du betrager de to ligevægtsbrøker ved du størrelserne Ks skal være bevaret. Det betyder i den første (1), når CO2 tilføjes i nævneren må tælleren samtidig blive større, og derfor dannes H2CO3 i den første. I den anden ligevægt (2), vil der jf. forrige argument dannes mere HCO3- og H3O+.
Fremgangsmåden er at opskrive ligevægtsbrøker og huske på Ks er en konstant størrelse og vurdere hvordan den forbliver konstant.
Skriv et svar til: Ligevægtsbrøk.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

