Kemi
Kemi syre og baser
a. Hvad er pH i opløsningen
b. Hvad er [h3o+] og pH efter tilsætning af 5,0 mL 0,100M NaOH
c. Hvad er [h3o+] og pH efter tilsætning af 10,0 mL 0,100M NaOH
d. Hvad er [h3o+] og pH efter tilsætning af 15,0 mL 0,100M NaOH
Jeg har fået a til at være 1.
Kan nogle vise trin for trin hvordan man udregner b, c og d ? Og lige fortælle hvad de får i a :)
Svar #1
26. november 2014 af OliverGlue
a.
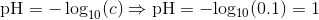
Reaktionen mellem saltsyre og natriumhydroxid er
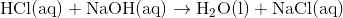
Vi husker også en stærk syre dissocierer til hydronium og en stærk base til hydroxid, derfor kan vi også skrive
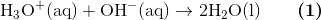
når vi har tilsat 5mL 0.1M NaOH må stofmængden af hydronium altså falde tilsvarende, da de reagerer i forholdet 1 til 1, og reaktionen er ikke en ligevægt.
b.
Vi har en stofmængde af HCl inden tilsætning af NaOH
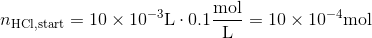
og der tilsættes
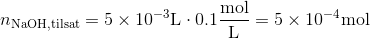
Stofmængden af HCl, når de er blandet må altså være HCl,start minus NaOH,tilsat, da en HCl reagerer med en NaOH.
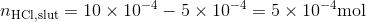
Koncentrationen kan findes og vi husker det er en stærk syre, så den antages at dissocierer fuldstændigt, og danne en tilsvarende mængde hydronium
![\mathrm{[H_{3}O^{+}]=\dfrac{5\times10^{-4}mol}{15\times10^{-3}L}=\dfrac{1}{30}\dfrac{mol}{L}}\Rightarrow\mathrm{pH=-log_{10}\left(\dfrac{1}{30}\right)}=1.48](https://media.studieportalen.dk/images/equations/urTZqc6VFcchr-NgrdgMag==.gif)
c.
(Du kan sikkert også sige pH af rent vand er 7)
Du blander ækvivalente mængder stærk syre og base, og jf. (1) vil du blot have en ren vandig opløsning, pH af en ren vanding opløsning bestemmes af vands autoprotolyse som er
![\mathrm{2H_{2}O(l)\rightleftharpoons H_{3}O^{+}(aq)+OH^{-}(aq)\qquad}Q=\mathrm{[OH^{-}][H_{3}O^{\text{+}}]}\quad K_{\mathrm{v}}=1\times10^{-14}\mathrm{}](https://media.studieportalen.dk/images/equations/iJ-DDl2kws4MfcP5OglyLQ==.gif)
Ved ligevægt har du Q er lig med ligevægtskonstanten det giver, og vi husker det må være ækvivalente mængder hydroxid og hydronium, da de er dannet fra i forholdet 1:1.![x^{2}=1\times10^{-14}\Rightarrow[\mathrm{H_{3}O^{+}]}=1\times10^{-7}\Rightarrow\mathrm{pH=-log(10^{-7})=7}](https://media.studieportalen.dk/images/equations/Mg6wVJaNBwOjTIerbm6QZA==.gif)
Svar #2
26. november 2014 af OliverGlue
d.
Når du har tilsat 15mL NaOH, vil alt HCl være omdannet og tilbage er 5mL NaOH á 0.1M
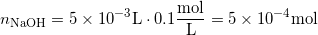
Koncentrationen kan findes og deraf pOH og pH
![\mathrm{[OH^{-}]=\dfrac{5\times10^{-4}mol}{25\times10^{-3}L}\Rightarrow pOH=-log_{10}(\dfrac{1}{50})=1.7\Rightarrow pH=14-1.7=12.3}](https://media.studieportalen.dk/images/equations/7cnM7RkZXt8L4mAJRnMPUg==.gif)
koncentrationen af hydronium er nu bestemt af ligevægten mellem hydronium og OH-, også kendt som vands autoprotolyse, det giver
![\small 1\times10^{-14}=\mathrm{\dfrac{1}{50}\cdot[H_{3}O^{+}]}\Rightarrow\mathrm{[H_{3}O^{+}]=}5\times10^{-13}\mathrm{M}](https://media.studieportalen.dk/images/equations/hyOGYFngweUptCljL1v5dQ==.gif)
Skriv et svar til: Kemi syre og baser
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


