Kemi
Beregning af bicarbonatkoncentration
Følgende opgave:
Prøve pH pCO2
normal 7,4 5,3kPa
X 7,2 9,0kPa
Y 7,2 5,4kPa
Beregn bicarbonatkoncentrationen [HCO3-] i hver af de tre blodprøver normal, X og Y.
Nogen der kan hjælpe? Jeg ved ikke helt hvor jeg skal starte.
Svar #2
29. november 2014 af OliverGlue
#1 Hvad er ligevægtskonstanten for din ligevægt og molariteten af CO2?
#0 Du kan finde CO2(aq) ud fra Henrys lov, da partialtrykket er tilstrækkelig lavt. Du kan finde koncentrationen af kulsyre ved
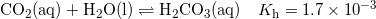
Kulsyre er i ligevægt med hydrogencarbonat, som du skal finde
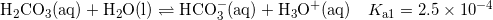
hvor du skal huske hydronium er konstant, da pH er opgivet.
Pointen med mit indlæg er, man ikke kan identificere ligevægtskonstanten for #1. Hvis man adderer de to reaktioner, jeg har skrevet op, får man
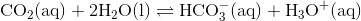
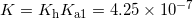
som netop er lig med ligevægten i #1.
Skriv et svar til: Beregning af bicarbonatkoncentration
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




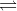 CO2 + H2O
CO2 + H2O