Naturvidenskabeligt grundforløb (NVG)
Kemisk termodynamik
Jeg skal beregne vands modtagelse af energi fra en peanuts forbrænding.
Jeg har følgende formel:
Emodtaget = m * c * t2 - t1
Hvordan forklarer jeg at hvis jeg opvarmer 25g vand med en temperaturtilvækst på 10oC, svarer den procentvise energimodtagelse til 50g vand med en temperaturtilvækst på 20oC? Og er der overhovedet hold i teorien?
Mange tak på forhånd,
Svar #1
09. december 2014 af Heptan
Du kan jo bruge formlen til at beregne energien i joule.
For vand er c = 4,18 kJ/(kg * °C)
Det bliver så til
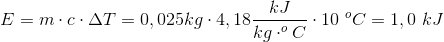
Hvis vi så har 50 g vand istedet, og opvarmer 20 grader, så får vi:
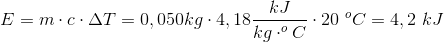
Det holder altså ikke. Hvis vi bruger den samme procentvise energi til at opvarme 25 g vand som til at opvarme 50 g vand, vil de begge stige 10 grader.
Svar #2
09. december 2014 af mathon
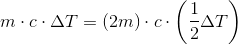 er god nok
er god nok
men ikke både en fordobling af masse og temperaturændring, som du foreslår i #0.
Svar #3
09. december 2014 af ntrbd (Slettet)
Ja. Jeg har beregnet det for begge vandmasser.
Den modtagede energi for 25g vand er 1045J.
E = m * c * t2-t1 = 0,05kg * 4,18kJ/kg*oC*10oC * 20oC = 2090J.
Jeg øgede vandets masse med 100%, fordi jeg antog at det vil kræve samme procentvise mængde energi at opvarme de to forskellige masser hver især, men at risikoen for spildenergi ved energiomdannelse ville blive reduceret med 50%.
Jeg kan godt se, at 2090J/1045J og 50g/25g = 2,
og at kvotienten af 2090J/4,18/50g=10oC
og det samme gør sig gældende for 1045J/4,18/25g=10oC,
men jeg ved ikke hvordan jeg skal udtrkke sammenhængen mellem de to tal?
Svar #4
09. december 2014 af ntrbd (Slettet)
#2
er god nok
Kan du uddybe for en uerfaren 1.-g'er? :))
Svar #5
09. december 2014 af Heptan
Hvis man både fordobler massen, og fordobler temperaturtilvæksten, så svarer det til at man skal bruge 4 gange så meget energi (2*2), eller dobbelt så meget energi pr. L vand.
Svar #6
09. december 2014 af ntrbd (Slettet)
Tak for jeres (hurtige) svar. De virker meget mere fornuftige!
Her er min lærers forslag. Jeg har regnet efter og rettet i resultaterne. Så forstår jeg ikke hvad han forsøger at vise med formlen?
Svar #7
09. december 2014 af Heptan
#6
Jeg tror at du i #0 byttede rundt på masserne.
Din lærer bruger den samme mængde energi til at opvarme de to systemer.
Når der er 50 g vand, kan han opvarme vandet 10 grader.
Når der kun er 25 g vand, så har han kun brugt halvdelen af sin energi, når han har opvarmet 10 grader. Så han vælger lige at bruge resten på at opvarme vandet 10 ekstra grader. I alt 20 grader.
I overensstemmelse med
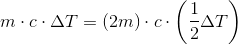
Venstresiden: Der bruges (m = 25 g) vand, og der opvarmes (ΔT = 20 grader)
Højresiden: Der bruges dobbelt op med vand (2m = 50 g), men der opvarmes kun halvt så meget som før (1/2 ΔT = 10 grader)
Svar #8
09. december 2014 af ntrbd (Slettet)
Mange tak! Nogle gange har man brug for et tredje øje. :-)
God aften.
Skriv et svar til: Kemisk termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






