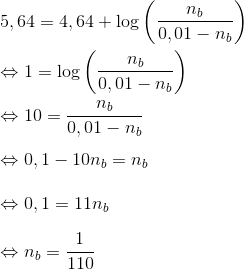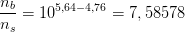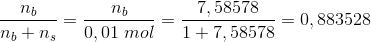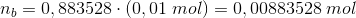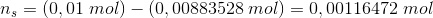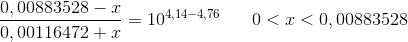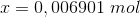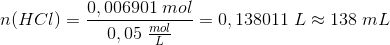Kemi
Stofmængde HCl til at ændre pH 1.5 enheder i puffersystem?
Der beregnes, hvor meget CH3COONa · 3H2O, der skal afvejes, for at opnå 100 mL af
en puffer med en totalkoncentration på 0,1 M. Dette er gjort i opgave D18. Denne
mængde natriumacetat afvejes og overføres til et 250 mL bægerglas, hvortil der
tilsættes 90 mL destilleret vand.
Beregn hvilket volumen 0,1 M HCl, der skal tilsættes for at få pH = 5,64. Dette er gjort i
opgave D18. Tilsæt ¾ af dette volumen. Tilsæt derefter langsomt yderligere HCl, under
måling af pH med et pH-meter, indtil den ønskede pH nås.
[...]
Beregn hvor meget 0,05 M HCl henholdsvis NaOH, der skal tilsættes til hvert
puffersystem, for at pH ændres én enhed fra den oprindelige værdi. Sammenlign med
de eksperimentelle data.
[...] I beregninger kan følgende pKS-værdier anvendes:
pKS(CH3COOH) = 4,64
pKS(H2PO4−) = 6,80
[...]
Nogen der vil give mig nogle pointers? Jeg ved henderseon-hesselbach ligningen skal bruges, men aner ikke hvordan jeg kommer frem til stofmængde
Svar #1
19. december 2014 af Heptan
I Henderson-Hesselbach ligningen indgår stofmængden direkte ved
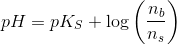
hvor 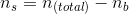
For pH = 5,64 og n(total) = 0,01 mol
er 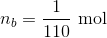
______________________________
Indsættes pH = 5,64 + 1
fås løsningen 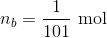
Dvs. der er tilsat
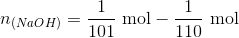
_______________________________
Bemærk at pH = 5,64 - 1 = 4,64 = pKs
Derfor er der lige store mængder af den svage syre og den svage base når pH = 4,64. Dvs. der er tilsat
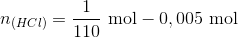
Svar #4
19. december 2014 af feynman (Slettet)
Det du har beregnet er hvor meget NaOH man skal tilsætte opløsningen for at pH ændres én enhed?
Skriv et svar til: Stofmængde HCl til at ændre pH 1.5 enheder i puffersystem?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.