Kemi
pH og pOH H^+ oh OH^-
God aften.
Er der en der er sød, at hjælpe med forskellige udregninger til pH og pOH H^+ og OH^-? - disse opløsninger:
- Altså hvordan udregner jeg, punkt til punkt?
- Det vigtigste er at forstå hvordan jeg regner det ud. Hvilke formler jeg skal bruge.
Svar #2
21. januar 2015 af LubDub
HCl er en stærk syre: pH = - log(cs)
NaOH er en stærk base: pOH = - log(x•cb) = log[OH -]
HF er en svag syre: pH = 1/2(pKs - logcs)
Na2SO4 er en neutral salt
........................
Der gælder
[H3O+] • [OH -] = Kv = 10-14 M2 (25 oC)
pH + pOH = pKv = 14
Og den genelle formel for et metalhydroxid er givet ved: Me(OH)x (s).
For NaOH er x = 1, men for fx Ba(OH)2 er x = 2
Svar #3
21. januar 2015 af Mayna (Slettet)
Hvad skal man gøre med Na2SO4?
Det vil sige jeg først skal finde koncentration ved at jeg først siger:
m*M=n også finder jeg koncentration ved c=n/V
Eller skal jeg bruge pKs værdier?
Svar #5
21. januar 2015 af Heptan
#4
HF er en svag syre: pH = 1/2(pKs - logcs)Na2SO4 er en neutral salt
(...)
Og den genelle formel for et metalhydroxid er givet ved: Me(OH)x (s).
Formelt set er HF en middelstærk syre.
Sulfat er en meget svag base, og det er kompliceret at beregne pH i en sådan opløsning, men pH > 7.
Me(OH)x er ikke at forveksle med MeOH, methanol, som dog oftest skrives CH3OH.
Svar #7
21. januar 2015 af Mayna (Slettet)
Hvordan beregnes cs så? Er det ikke koncentrationen?
og går ud fra at Ks er det samme som pKs
Svar #8
21. januar 2015 af Heptan
#7
På C-niveau kræves det ikke at man kan beregne pH i opløsninger af meget svage baser.
cb er den formelle koncentration af basen, og du har skrevet den er 0,1 mol/L for natriumsulfat.
cs er den formelle koncentration af en syre.
pKs = -log Ks
Svar #9
21. januar 2015 af mathon
pH-beregning for en meget svag base, her SO42- (for en stræbsom C-niveaustuderende)
ved 25°C:
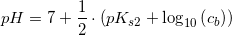
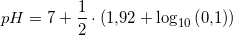
Svar #10
22. januar 2015 af Heptan
#9
Formlen er kun gyldig for 4 < pKs < 10.
For 0 < pKs < 4 er basen så svag, at man ikke kan se bort fra vands egendissociation og man risikerer derfor at få en pH-værdi mindre end 7 når man regner på en basisk opløsning.
For [SO42-] >> [HSO4-] fås cb ≈ [SO42-] og dermed
![K_b=\frac{[OH^-]^2-K_w}{c_b}](https://media.studieportalen.dk/images/equations/wWivYD9SBhoMw856bXRcFg==.gif)
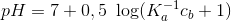
Svar #12
22. januar 2015 af Mayna (Slettet)
Det vil sige for HF er pH=
pH=-log((3,14+√(3,14^2+3,14*0,6mol/L))/2)
ph=−0.562935
Svar #15
22. januar 2015 af Mayna (Slettet)
Der står i opgaven udregn at jeg skal beregne pH, pOH, [H^+] og [OH^-] i opløsningerne..
Hvad menes der med at [H^+] og [OH^-], hvordan skal jeg regne det ud??????
Svar #18
23. januar 2015 af Mayna (Slettet)
For HCl
pH=-log(0,6mol/L)=0.22
pH=10^-0.22=0.60,
Så pH for HCl=0,60??
Skriv et svar til: pH og pOH H^+ oh OH^-
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






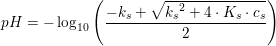
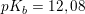
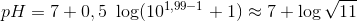
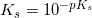
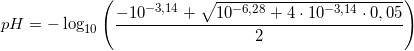
![[H^+]=10^{-pH}](https://media.studieportalen.dk/images/equations/GT3P4x-6aj_cEDCwAKRB9A==.gif)
![[OH^-]=10^{-pOH} =10^{pH-14}](https://media.studieportalen.dk/images/equations/1D507xGrYLMM_8BO30Yntw==.gif)