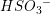Kemi
Aktuel koncentration
Tilsættes NaHSO3 til 1 L vin, så den formelle koncentration Cs, er 0,1 M
Hvad bliver så de aktuelle koncentrationer af H2SO3 og HSO3-
Er der nogen der lige kan hjælpe her, for jeg ville jo mene den aktuelle koncentration udregnes ved c=n*V=(m/M)*V. JEg kan ikke få det til at virke?
Svar #1
23. januar 2015 af mathon
I den udstrækning vinen fortrinsvis kan betragtes som vand ved 25°C
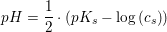
![\small x=\frac{1}{1+10^{pH-pK_s}}=\frac{\left [ HS{O_{3}}^{-} \right ]}{c(HS{O_{3}}^{-})}](https://media.studieportalen.dk/images/equations/8JWTXF_HvX3ZNGdrkarTQw==.gif)
hvor
Svar #2
24. januar 2015 af LolLars (Slettet)
Tak for hjælpen, jeg forstår det dog stadig ikke helt i det jeg da ikke har koncentrationen af tælleren? :)
Skriv et svar til: Aktuel koncentration
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





![\small \frac{ \left [ OH^- \right ]^2 }{0,1-\left [ OH^- \right ]}=10^{-12,19}\; \; \; \; \; \; 0\leq \left [ OH^- \right ]\leq 0{,}1](https://media.studieportalen.dk/images/equations/1h30JCDEGBQZfPvggKjc5w==.gif)
![\small \left [ OH^- \right ]=2,55\cdot 10^{-7}\; M](https://media.studieportalen.dk/images/equations/Jcmhtx2Fq_DMOyr8bjwC7w==.gif)
![\small pH=14+\log(\left [ OH^- \right ])=14+\log(\left [2{,}55\cdot 10^{-7} \right ])=7{,}4](https://media.studieportalen.dk/images/equations/LONsqmU7iKOIiHaEHHxkyw==.gif)
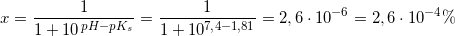
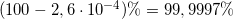 befinder sig som
befinder sig som