Kemi
Hjælp til termodynamik
1. Beregn hvor meget varme der udvikles når man afbrænder 1,00 liter ethanol
2. Hvor meget varme skal der til at opvarme 3,00 kg vand fra 10 grader til 95 grader?
Svar #1
23. januar 2015 af Heptan
2 CH3CH2OH + 7 O2 -> 4 CO2 + 6 H2O
Du kan beregne den ekstensive reaktionsenthalpitilvækst eller slå brændværdien op.
2.
Slå den specifikke varmekapacitet op for vand
Svar #2
24. januar 2015 af hioghi (Slettet)
Det forstår jeg ikke . hvis jeg skal beregne ud fra enthalpi, så beregner jeg jo hvor meget varme der afsættes ud fra én mol ethanol. Hvordan skal jeg så beregne det ud fra 1 liter, når jeg finder enthalpi for stofferne i kJ/mol?
Svar #3
25. januar 2015 af Heptan
Nej, du skal beregne den ekstensive reaktionsenthalpitilvækst, og ikke den intensive som man normalt bruger.
Formelt set er enthalpifunktionen en ekstensiv funktion, dvs. den afhænger af hvor meget stof der er, men det er ofte underforstået at man regner med den molare enthalpitilvækst, som er en intensiv funktion (den er uafhængig af hvor meget stof der er, og kan passende angives i kJ/mol).
Du skal altså beregne stofmængden af 1,00 L ethanol og gange med ΔrHm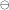 , den molare reaktionsenthalpitilvækst, så får du den ekstensive reaktionsenthalpitilvækst (når stofferne er i deres standardtilstand).
, den molare reaktionsenthalpitilvækst, så får du den ekstensive reaktionsenthalpitilvækst (når stofferne er i deres standardtilstand).
Skriv et svar til: Hjælp til termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


