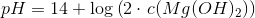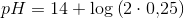Kemi
Beregning af pH
Hej derude
Er der en, som kan hjælpe mig med følgende opgaver?
1)
Beregn pH-værdien for en opløsning af Mg(OH)2 med en formel koncentration på 0,25 M
2)
Beregn pH-værdien i en opløsning af 0,40 mol HSO3- og 0,20 mol SO32-
Svar #4
19. februar 2015 af josefinehamgaard (Slettet)
#3
Jamen, hvad er pH så? Kan ikke finde ud af at regne det der ud.
Svar #5
19. februar 2015 af Heptan
#4
c er den formelle stofmængdekoncentration, som du har fået opgivet.
Svar #7
20. februar 2015 af mathon
Beregn pH-værdien i en opløsning af 0,40 M HSO3-
HSO3- er en amfolyt pKs ≈ pKb ≈ 7
beregnet som amfolyt:
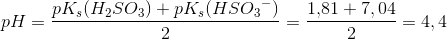
beregnet som svag syre:
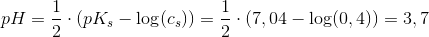
Svar #9
20. februar 2015 af mathon
Beregn pH-værdien i en opløsning af 0,20 M SO32-
beregnet som svag base
ved 25°C:
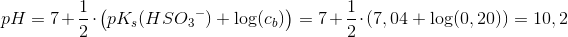
Svar #10
20. februar 2015 af Heptan
#7Beregn pH-værdien i en opløsning af 0,40 M HSO3-
HSO3- er en amfolyt pKs ≈ pKb ≈ 7
beregnet som amfolyt:
beregnet som svag syre:
Det er da uden betydning at pKs ≈ pKb ≈ 7? Antagelsen bør vel snarere være at pKs(H2SO3) ≈ pKs(HSO3-), hvilket er en dårlig antagelse. Men hvad gør man så, man kan jo ikke se bort fra at det er en amfolyt?
Svar #11
20. februar 2015 af Heptan
Beregn pH-værdien i en opløsning af 0,40 M HSO3-
HSO3- er en amfolyt med pKs(H2SO3) = 1,81 og pKs(HSO3-) = 7,04.
Det antages at HSO3- har en metalionledsager M+.
Heraf fås ladningsbevarelsen
1) ![[H^+]+[M^+]=[HA^-]+2\ [A^{2-}]](https://media.studieportalen.dk/images/equations/LeGWp1RJ4dvWZ4BZlANYZg==.gif)
og de to ligevægtsudtryk
2) ![K_1 =\frac{[HA^-]}{[H_2A]}[H^+]](https://media.studieportalen.dk/images/equations/8_rU1t829Ms9_kk2gbJn-w==.gif)
3) ![K_2 =\frac{[A^{2-}]}{[HA^-]}[H^+]](https://media.studieportalen.dk/images/equations/hoIDq1A7apTaQBO8IYpQUA==.gif)
og stofbevarelsen
4) ![[M^{+}]=[H_2A]+{[HA^-]}+[A^{2-}]=0,40\ \textup{M}](https://media.studieportalen.dk/images/equations/1S0OZ8vS9HzLqrvIWEnCWg==.gif)
og selvfølgelig pH
5) ![pH=-\log [H^+]](https://media.studieportalen.dk/images/equations/SjMNhAM4opk18jCEl5frPw==.gif)
Løses de fem ligninger fås
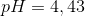
Dvs. amfolytformlen beskriver pH bedst, idet denne også giver
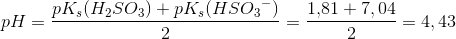
Svar #12
03. august 2015 af Soeffi
#0 ...2) Beregn pH-værdien i en opløsning af 0,40 mol HSO3- og 0,20 mol SO32-
Man skal nok bruge pufferligningen.
Svar #13
13. august 2015 af Heptan
#11 Korrektioner:
[M+] = 0,80 M da sulfit også har en metalionledsager.
Det antages at volumen er 1 L. Amfolytformlen er dog uafhængig af volumen.
#12 HSO3- er både en syre og en base, dvs. en amfolyt. Man skal bruge amfolytformlen.
Pufferligningen giver pH = 6,74 og amfolytformlen giver pH = 4,43.
Skriv et svar til: Beregning af pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![pH=14+\log\left ( \left [ OH^- \right ] \right )](https://media.studieportalen.dk/images/equations/CRyVnu2_JVchyNBgK6uJtw==.gif)
![pH=14+\log\left ( 2\cdot \left [ Mg(OH)_2 \right ] \right )](https://media.studieportalen.dk/images/equations/7xYq6w8uiy9ZxJJC8bXmBg==.gif)