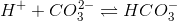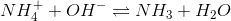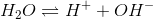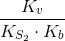Kemi
Ligevægtskonstant
Hej.
Jeg har prøvet at regne mig til nogen resultater i opgaven som jeg har vedhæftet. Jeg får blandt andet ligevægts konstanten i den første til at være 1.318*10^-3. Men jeg er rimelig usikker på dette resulatet. Håber nogen der kan hjælpe.
Svar #3
28. februar 2015 af Soeffi
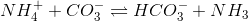
er den modsatte ligevægt til summen af ligevægtene:
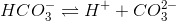
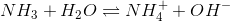
Ligevæktskonstanten er derfor
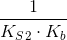
Svar #4
28. februar 2015 af jan12344 (Slettet)
Som jeg ser det har vi følgende ligevægte konstanter:
Ks2=[CO32-]*[H+]/[HCO3-] =>
1/Ks2=[H+]*[HCO3-]/[CO32-] og (med samme princip)
1/Kb=[OH-]*[NH3] / [NH4+]
Men hvordan opskriver du den ligevægt man skal beregne ligevægtkonstaten for: Jeg ser det som
K=[NH3]*[HCO3-] / [NH4+]*[CO32-].
Men før jeg kan erstatte disse udtyk med dem jeg har fundet fra de andre ligevægte må jeg vel forlænge med noget. Ved kun syre konstanter plejer at forlænge med [H+]/[H+], men i dette til fælde har jeg også OH-. Det er her det går galt for mig? Kan jeg godt omregne Kb til Ks med denne formel: Kv=Kb* Ks => Kb=Kv/ Ks , Kv= vandsionproduk. Men hvis jeg gør det for jeg ikke samme resultat for ligevægtskonstanten som med det udtryk du har fundet.
På forhånd tak.
Svar #6
28. februar 2015 af jan12344 (Slettet)
Det forstår jeg ikke. Hvad er det jeg skal gange med 1*10^-14 M^2 og hvorfor?
Svar #7
28. februar 2015 af jan12344 (Slettet)
Og lagde lige mærke til en fejl i #4. Jeg mener selvføgelig: Kv=Kb* Ks => Ks=Kv/ Kb og ikke Kb=Kv/ Ks.
Svar #9
28. februar 2015 af jan12344 (Slettet)
Ja jeg kan godt se hvor du vil hen. Jeg får nemlig det samme ved at omregne kb til ks med denne formel Ks=Kv/ Kb og bare derved forlænge med [H+]/[H+], I begge tilfælde ender jeg op med et resultat på 10. Men hvis jeg beregner PH ud (hvilket jeg skal i opgaven) kan jeg se at jeg får PH=0.32, med ligvægt konstanten 10. Er dette ikke lige lovligt lavt. Eller er det mig der har regnet forkert.
Desuden ville jeg værdsætte hvis du havde en ide om hvordan jeg skal beregne alle koncentrationerne i opgaven. Jeg har prøvet i noget tid på at finde en måde på hvordan dette kan gøres, da jeg ikke får angivet en koncentration af nogen af speciserne, hvilket kun er det jeg har fået træning i at løse. Har du nogen ide om hvordan jeg skal starte.
Jeg takker for din tid :)
Svar #11
28. februar 2015 af Soeffi
Den formelle koncentration af (NH4)2CO3 er 0,15M. Heraf følger massebalancerne
[NH4+]+[NH3]=2·0,15M = 0,30M
[HCO3-]+[CO32-] = 0,15M
[NH3]=[HCO3-], idet det antages, at HCO3- kun dannes ved reaktionen mellem NH4+ og CO32-, og man ser bort fra bidraget fra luftens indhold af CO2.
Sættes [NH4+] = x fås
[NH3] = 0,3M - x = [HCO3-]
[CO32-]=0,15M-(0,3M-x)=x-0,15M
Dette indsættes i ligevægten [NH3][HCO-]/[NH4+][CO32-] = K= 10-14M2/10-10,25M·10-4,75M = 10 og man får
(0,3M-x)2/x(x-0,15M) = 10 =>
(0,3M-x)2= 10x(x-0,15M) =>
-9x2+0,9Mx+0,09M2=0 =>
x=0,05M±0,5√(0,05M)2 =>
x=0,162M
Dette giver
[NH4+]=0,162M
[NH3]=[HCO3-]=0,138M
[CO32-]=(0,162-0,15)M=0,012M
Af ligevægten [OH-][NH4+]/[NH3]=10-4,75M => [OH-] = 10-4,75·(0,138M/0,162M) = 1,51·10-5M
Af vandets ionprodukt fås [H+] =10-14M2/1,51·10-5M = 6,6·10-10M
pH = -log(6,6·10-10M) = 9,18
Svar #12
28. februar 2015 af jan12344 (Slettet)
Jeg ville lige starte med at sige tusiinde tak for den grundige besvarelse. Grundigheden du har lagt i at besvare mit spørgsmål har virklig givet mig en bedre indblik i hvordan sådanne opgaver skal besvares. Jeg har dog et par sidste afrundende forståelses spørgsmål, jeg håber du vil kigge på. Det er nok massebalancerne der driller.(Jeg ved godt der er rimelig basalt i forhold til resten, men alligvel er det her jeg mister forståelen). Som jeg ser det starter vi med følgende ligevægt.
(NH4)2CO3(s) <=>2NH4+(aq) + CO3-(aq)
dvs. 2NH4+(aq) + CO3-(aq)= 0.15M (eller hvad?)
Spg 1:
Af ligevægten:
NH3++HCO3- <=> NH4++CO32-
Hvordan når du frem til:
[NH4+]+[NH3]=2·0,15M = 0,30M (Går udefra du ganger med 2 fordi der står 2 foran NH4+(aq). Eller???)
[HCO3-]+[CO32-] = 0,15M
og mest vigtigt:
[NH3]=[HCO3-], idet det antages, at HCO3- kun dannes ved reaktionen mellem NH4+ og CO32-, og man ser bort fra bidraget fra luftens indhold af CO2.
Svar #14
01. marts 2015 af Soeffi
#13.
Det er rigtigt med NH4+. Du kan se bort fra HCO3-, der stammer fra luftens CO2, fordi KS1 er meget lav.
Svar #15
01. marts 2015 af jan12344 (Slettet)
Når du skriver: " at HCO3- kun dannes ved reaktionen mellem NH4+ og CO32-," mener du så at NH3 også kan dannes på en anden måde end hvad lige vægten angiver. NH4+ + CO32- danner jo også ammoniak. Men hvorfor er det kun ammoniaken der er vigtig? Ammoniumionen afgiver jo en proton til carbonaten, og danner HCO3-, men hvorfor er dennes koncentration ikke vigtig? (Er det fordi at Ks2 er meget lav for denne. )
Desuden ville jeg høre om man godt kan opskrive dette skema for ligevægten.
NH4+ + CO32- <=> NH3 + HCO3-
Start: 0,30M 0,15M 0,30M 0,15M
Ligevægt: x 0,15M-(0,30M-x ) 0,30M-x 0,30M-x
Svar #16
01. marts 2015 af Soeffi
#15
Du behøver ikke tænke på, hvad der er af mulige ligevægte. Du har to lovmæssigheder:
1) Ligevægtsloven og
2) Loven om massens konstans.
og det er dem du bruger.
Svar #17
01. marts 2015 af jan12344 (Slettet)
Okay, jeg må vel bare nøjes. Men i #15 kan jeg godt angive start koncentrationerne som jeg har gjordt i skemaet.
Svar #18
01. marts 2015 af Soeffi
#16
Jeg burde sige, at jeg ser bort fra at ammoniak kan fordampe til atmosfæren, hvorved massen konstans ikke ville gælde for opløsningen (som nævnt ses der bort fra optagelse af CO2, der også kunne ødelægge brugen af massens konstant for opløsningen). Desuden ser jeg bort fra koncentrationen af H2CO3, da jeg antager, at opløsningen er basisk, hvilket den også viser sig at være.
Svar #19
01. marts 2015 af Soeffi
#17Okay, jeg må vel bare nøjes. Men i #15 kan jeg godt angive start koncentrationerne som jeg har gjordt i skemaet.
Du kan godt bruge skemaet fra #15, men fokuser altid på massens konstans, for hvis du har flere sammenhængende ligevægte kan du blive tvivl om hvilket udtryk der skal stå hvor.
Svar #20
01. marts 2015 af jan12344 (Slettet)
#18: Ja, det er jeg indforstået i. Men det der undrede mig var bare hvorfor du kunne sætte [NH3]=[HCO3-]. Hvis vi antager at de begge ikke fordamper el. på nogen måder forstyrres, men bare reagere efter ligevægten, burde [HCO3-] så ikke have en koncentration på 0.15M, som ved ligevægt bliver til 0.15M-x. (Ikke fordi det du har skrevet forkert, for det stemme overens med mit facit.) Men hvis det bare er en eller anden lovmæssighed, må jeg vel bare lade vær med at tænke for meget over det.
Jeg takker for hjælpen.