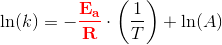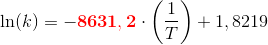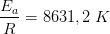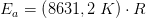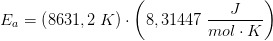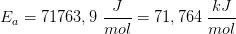Kemi
kemi kinetik
Hej, er der nogle som vil hjælpe mig med opgave b i denne opgave?
Svar #5
01. marts 2015 af Penalhuset (Slettet)
Nu taber jeg kræftedeme i poker!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Svar #7
01. marts 2015 af mathon
b)
Reaktionen har vist sig at forløbe som en 1.ordens reaktion
dvs
![\left [ 3\! -\! oxoPDS \right ]_t=\left ( 0,0100\; M \right )\cdot e^{-(5,76\cdot 10^{-3}\; min^{-1})\cdot t}](https://media.studieportalen.dk/images/equations/lTCo-5OL_MpfH-COcQf73w==.gif)
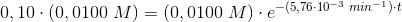
10% af begyndelseskoncentrationen:
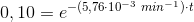
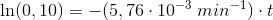
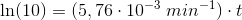
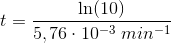
Svar #9
01. marts 2015 af lokpæø (Slettet)
Kan jeg spørge, om man ikke skal benytte termodynamik for at beregne aktiveringesenergien?
Skriv et svar til: kemi kinetik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.