Kemi
Reaktionskinetik
Er der nogle, som gerne vil hjælpe mig med opgave c og d?
Svar #2
01. marts 2015 af Soeffi
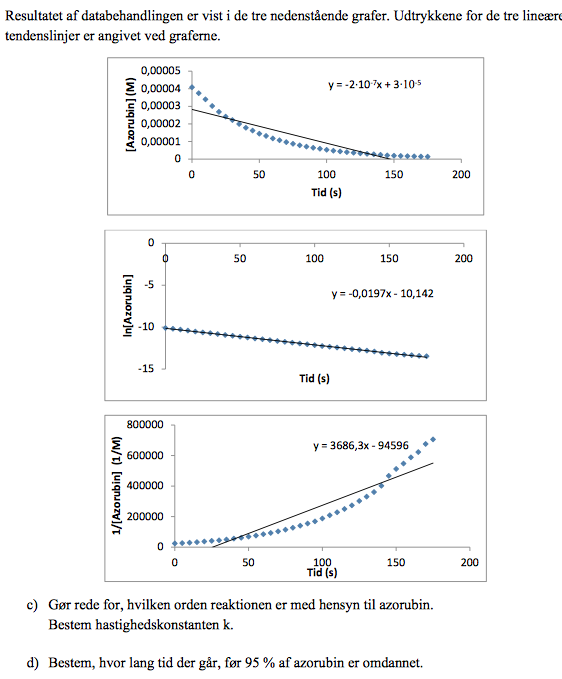
På den midterste graf passer punkterne på grafen med en ret linje. Da y-aksen viser logaritmen til koncentrationen af det stof, som man vil bestemme reaktionsordenen med hensyn til, er reaktionen en første ordens reaktion med hensyn til Azorubin. Hastighedskonstanten aflæses til 0,0197M/s.
d) Formlen for den tid, som omdannelsen tager, er
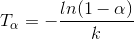
hvor α=0,95 og k er hastighedskonstanten.
Svar #4
01. marts 2015 af Soeffi
95% omdannelse svarer til, at der 5% tilbage af den oprindelige koncentration (til t=0).
![ln([Azorubin]_{t=0}\cdot 0,05)=-0,0197x-10,42\Rightarrow](https://media.studieportalen.dk/images/equations/1yK4eQ1gi4TrBl5WTepW0g==.gif)
![ln([Azorubin]_{t=0})+ln(0,05)=-0,0197x-10,42\Rightarrow](https://media.studieportalen.dk/images/equations/ejuaEV9_t_9pt8bCKy33Tw==.gif)
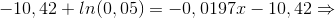
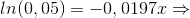
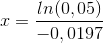
Svar #5
01. marts 2015 af paaske1 (Slettet)
Tak, skal du have :)
- men hvor får su -10.42 fra ved venstre side af lighedstegnet;
![[-10,42+ln(0,05)=-0,0197x-10,42\Rightarrow]](https://media.studieportalen.dk/images/equations/Q25i30RWdSK79hOhheSEMw==.gif)
Skriv et svar til: Reaktionskinetik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

