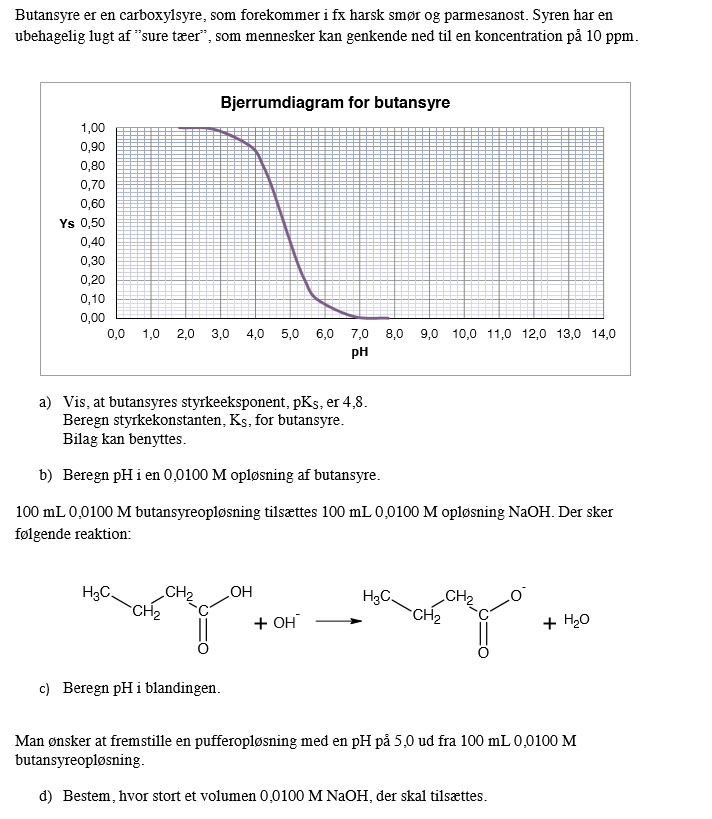
Kemi
pH
Hej, er der nogle, som kan vil hjælpe mig med opgave c og d?
Svar #2
02. marts 2015 af thomaslarsen91Arocketmailcom (Slettet)
det vil jeg også gerne høre, fordi det er helt sikkert forkert
Svar #4
02. marts 2015 af Soeffi
#3tak for ordene.. jeg fik til at være 3,4 ..
Det fik jeg også, hvad med b)?
Svar #5
03. marts 2015 af Soeffi
#4#3tak for ordene.. jeg fik til at være 3,4 ..
Det fik jeg også, hvad med b)?
Nåh nej, det var b), undskyld!
Svar #6
03. marts 2015 af Soeffi
#0 Man har en blanding med rumfang 200 mL.
Der sker reaktionen:
HB + OH- = B- + H2O,
hvor HB er butansyre og B- er dens korresponderende base.
I følge massens konstans fås [HB] + [B-] = 0,01M·(100mL/(200mL)) = 0,005M.
Ved ligevægt er reaktionen forskudt så meget mod højre, at man kan sætte [B-] ≈ 0,005M.
Samtidig har man gennem hele reaktionen, at [HB] = [OH-], da de to koncentrationer er lige store fra starten, og da stofferne reagerer med hinanden i forholdet 1:1.
Ligevægtskonstanten for reaktionen findes ved
HB + H2O = H3O+ + B-; Ks
H+ + OH- = H2O; 1/Kv
--------------------------------------
HB + OH- = B- + H2O; Ks/Kv
Man har dermed ligevægtsligningen [B-]/([HB][OH-]) = Ks/Kv, der giver:
0,005M/[OH-]2 = 10-4,8M/10-14M2 =>
[OH-]2 = 0,005M·10-14+4,8M =>
[OH-]2 = 5·10-14+4,8-2M2 =>
[OH-] = 1,1·10-6M
Dette giver:
[H+] = 10-14M2/1,1·10-6M = 8,9·10-9M =>
pH = - log( 8,9·10-9) = 8,0 (hvad siget facitlisten?)
Svar #8
04. marts 2015 af Soeffi
#0 opgave d)
Du har pufferligningen pH = pKs + log ([B]/[S])
som giver
5,0 = 4,8 + log ([B]/[S]) =>
log ([B]/[S]) = 0,2 =>
[B]/[S] = 100,2 =>
[B]/[S] = 1,58 =>
(antal mol base/antal mol syre) = 1,58
Antal mol base = VNaOH·0,01M
Antal mol syre = 0,001 mol - VNaOH·0,01M
Dette giver
(VNaOH·0,01M)/(0,001 mol - VNaOH·0,01M) = 1,58 =>
(VNaOH·0,01M) = 1,58·(0,001 mol - VNaOH·0,01M) =>
2,58·VNaOH·0,01M = 0,00158 mol =>
VNaOH = 0,00158mol/(2,58·0,01M) = 0,061L = 61mL
Skriv et svar til: pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

