Fysik
Atom
Hej,
Hvad er sammenhængen mellem lysets frekvens og lysets energi?? Og sammenhængen mellem energiniveau forskelle i atomer og lys bølgelængde?
Svar #1
30. marts 2015 af hstreg (Slettet)
Lad Eγ betegne energien af ét lystkvant (dvs. én foton) og ν frekensen af lyset/fotonen, da er sammenhængen imellem energi og frekvens givet som
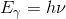
hvor h = 6.626•10^-34 J•s er plancks konstant (det mindste virkningskvantum).
Der findes ikke en genereal formel for energiforskellen imellem to kvantetilstande, for et vilkårligt atom/isotop fra det periodiske system. Men vi kan for bla. Brint-atomet.
Energien af den n'te tilstand i bringt atomet, er givet ved
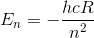
Hvor h igen er Plancks konstant, c lysets fart i vakuum og R er Rydbergs konstant.
Bohr postuleret bl.a. i sin kvnatefysiske model for brint atomet, at når én elektron fortog et kvante spring fra energiniveau m til energiniveau n (m > n), udsente brint-atomet en foton med energi svarende til denne energiforskel. Hvorfor
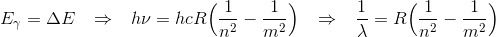
Hvor vi har brugt bølgeligningen : c = λν , hvor λ er bølgelængden af den udsendte foton.
Dette er også kendt som Rydbergsformel.
Hvis vi har at m < n skal elektronen i brint-atomet "optage" en foton med bølgelængde givet ved Rydbergsformel, for at fortage kvantespringet fra energitilstand m til energitilstand n.
Skriv et svar til: Atom
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




