Kemi
Beregn ammoniaks basestyrkekonstant
Opgave 3. Chromationen er en svag base med basestyrkekonstanten Kb = 10–7,49 M, dvs. ligevægtskonstanten for reaktionen: CrO42− + H2O ? HCrO4− + HO−
3a) Beregn [HO−] i en 0,150 M opløsning af natriumchromat, Na2CrO4. Beregn dernæst opløsningens pH.
Har jeg løst : [HO-]=7,0*10^-5 ; pH= 9,84
3b) Ammoniumionen er en svag, monovalent syre, hvis korresponderende base er ammoniak. Ligevægtskonstanten er K = 10−2,74 for reaktionen: NH4+ + CrO42− ? NH3 + HCrO4−
Beregn ammoniaks basestyrkekonstant.
En der kan hjælpe?
Svar #1
31. marts 2015 af christianper (Slettet)
også med 3c)
Ligevægten beskrevet i spørgsmål 3b) indtræder, når 3,041 g ammoniumchromat, (NH4)2CrO4, opløses i 200 ml vand. Beregn koncentrationen af NH3 foruden pH i den resulterende ligevægtsopløsning, idet rumfanget regnes for uændret. Molær masse/g·mol–1: (NH4)2CrO4: 152,07.
Svar #4
20. august 2015 af Soeffi
Opfølgning.
#0 Beregn ammoniaks basestyrkekonstant.
Du skal bruge princippet om, at ligevægtskonstanten for en sum at to reaktioner er produktet af de enkelte reaktioners ligevægtkonstanter. Desuden gælder, at ligevægtskonstanten til den modsatte reaktion af en reaktion er 1 divideret med ligevægtskonstanten for den oprindelige reaktion.
Man skal finde ligevægstkonstanten K1 for ammoniaks base-reaktion med vand:
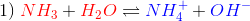
Man har med ovenstående farvemarkeringer:
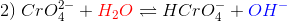
med ligevægtskonstanten K2 og
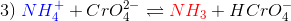
med ligevægtskonstanten K3.
Det ses nu at 1) = 2) - 3), hvilket vil sige, at K1 = K2/K3
= 10–7,49 M/10−2,74 = 10-7,49+2,74 M = 10-4,75 M = 1,78·10-5 M
Skriv et svar til: Beregn ammoniaks basestyrkekonstant
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



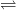 NH3 + HCrO4-
NH3 + HCrO4-![\frac{\left [NH_3 \right ]\cdot \left [HCr{O_{4}}^{-} \right ]}{\left [N{H_{4}}^{+} \right ]\cdot \left [ Cr{O_{4}}^{2-} \right ]}=\frac{\left [NH_3 \right ]\cdot \left [HCr{O_{4}}^{-} \right ]\cdot \left [ OH^- \right ]}{\left [N{H_{4}}^{+} \right ]\cdot \left [ Cr{O_{4}}^{2-} \right ]\cdot \left [ OH^- \right ]}=10^{-2,74}](https://media.studieportalen.dk/images/equations/wbpcseIKLlyazfgR7Dl5Fw==.gif)
![10^{2,74}\cdot \frac{ \left [HCr{O_{4}}^{-} \right ]\cdot \left [ OH^- \right ]}{ \left [ Cr{O_{4}}^{2-} \right ]}=\frac{\left \left [N{H_{4}}^{+}]\cdot [ OH^- \right ]}{\left [ NH_3 \right ]}](https://media.studieportalen.dk/images/equations/x-RGYDW5Jm7O1nmed2-BGg==.gif)
![10^{2,74}\cdot \left (10^{-7,49}\; M \right )=\frac{\left \left [N{H_{4}}^{+}]\cdot [ OH^- \right ]}{\left [ NH_3 \right ]}](https://media.studieportalen.dk/images/equations/0s0x2iqoSFWVHp0GtdV9lw==.gif)
![\frac{\left \left [N{H_{4}}^{+}]\cdot [ OH^- \right ]}{\left [ NH_3 \right ]}=k_b(NH_3)=1,77828\cdot 10^{-5}\; M](https://media.studieportalen.dk/images/equations/hIQrh8d0g7jJM-7XMkwdkA==.gif)