Kemi
Dekomponeringen af kaliumchlorat
Hej er der nogle der kan hjælpe med denne opgave?
Dekomponeringen af kaliumchlorat:
2KClO3( s) [\rightarrow] 2KCl( s) + 3O2( g)
Den frigivne O2( g) samles over vand til et totalt volumen på 34,7 mL.
Temperaturen er 24oC og totaltrykket er 0,996 bar. Partialtrykket af H2O(g) er 0,030 bar.
Hvad er massen af KClO3( s) der har reageret?
Svar #1
16. april 2015 af Heptan
Beregn stofmængden af gas over vand med idealgasloven, men træk stofmængden af vanddamp fra for at få n(O2).
Denne stofmængde er ækvivalent med en stofmængde af kaliumchlorat, og massen af denne er
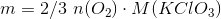
Svar #4
10. december 2015 af mille125 (Slettet)
for at få n(O2) siger du, n-n(H2O). Hvordan beregner man n og n(H2O)?
Svar #5
10. december 2015 af Soeffi
#4 for at få n(O2) siger du, n-n(H2O). Hvordan beregner man n og n(H2O)?
Du kender ikke n (den totale stofmængde) eller n(H2O) (stofmængden af vand), men du kender totaltrykket p og partialtrykket p(H2O). Det er det som er pointen i omskrivningen.
Svar #6
10. december 2015 af mille125 (Slettet)
Skal jeg beregne den totale stofmængde og stofmængden af vand, ved at bruge totaltrykket og partialtrykket? jeg er stadig forvirret.
Skriv et svar til: Dekomponeringen af kaliumchlorat
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


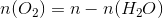
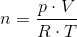
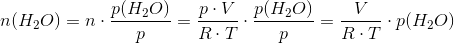
![n(O_{2})=\frac{V}{R\cdot T}\cdot[p-p(H_{2}O)]](https://media.studieportalen.dk/images/equations/us1ZoHmHOlL-JFIjxZxdzA==.gif)