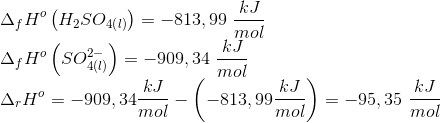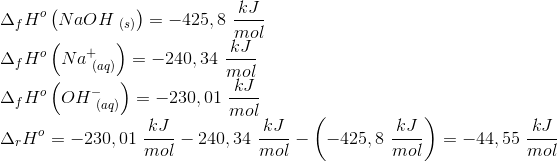Kemi
Vand i base
Hej
I min fysik bog står der, at man ikke må puttet vand i syre, da der så sker en kemisk reaktion, men må man så godt putte vand i base? - og hvorfor kan må man det eller hvorfor må man ikke det?
Svar #1
25. april 2015 af mathon
Det er mest aktuelt for koncentreret svovlsyre hvis massefylde er 1,842 g/mL, hvor vands massefylde er 1,00 g/ mL.
Tilsættes lidt vand, vil vandet flyde ovenpå og samle sig i et lille område, som
grundet
den stærkt varmeudviklende proces:
H2SO4 (aq) + 2 H2O (l) 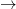 SO42- (aq) + H2 (g) + varme
SO42- (aq) + H2 (g) + varme
vil kunne få den lille vandmængde til at koge, så damp løsrivses i stød indeholdende små dråber koncentreret svovlsyre, som vil kunne ætse øjne, ansigt og tøj (derfor beskyttelsesbriller).
Hvis omvendt syren hældes i vand, vil syren gå til bundes og blandes med vand på et stort område, så den udviklede varme fordeles på en større vandmængde, som har en stor varmekapacitet.
Fænomenet har også relevans for andre koncentrerede syrer, hvorfor reglen
er:
syre i vand og aldrig omvendt!
Svar #3
25. april 2015 af Heptan
#1H2SO4 (aq) + 2 H2O (l)
SO42- (aq) + H2 (g) + varme
Jeg er ikke helt enig i ladnings- og stofbevarelsen her
Svar #4
25. april 2015 af mathon
#3
skal selvfølgelig være:
H2SO4 (aq) + 2 H2O (l) 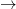 SO42- (aq) + 2 H3O+ (aq) + varme
SO42- (aq) + 2 H3O+ (aq) + varme
Skriv et svar til: Vand i base
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.