Fysik
Fordampningsvarme
Hej, jeg sidder med følgende opgave:
Vanddamp ved 100 ºC skal ledes ned i en kalorimeterskål med 500 g vand med temperaturen 20 ºC. Når temperaturen er steget til 100 ºC, afbrydes damptilførslen. Vandmassen er da vokset til 582 g. Kalorimetrets varmekapacitet er 100 J/K.
Afhænger varmekapaciteten ikke af hvor meget vand der er i kalorimeteret? Er værdien 100 J/K så for 500 g vand eller 582 g vand?
a) Hvor meget energi er optaget af hele systemet?
Er det er trickspørgsmål? Energien er vel bevaret i systemet?
b) Hvor meget energi afgav vanddampen?
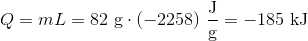
Dvs. 185 kJ
c) Hvor mange % gik tabt ved forsøget?
d) Hvilken værdi får vi for fordampningsvarmen, hvis vi ser bort fra tabet til omgivelserne?
Svar #1
25. april 2015 af peter lind
a) er et hjælpespørgsmål ikke et trickspørgsmål. Du får at vide at energien er bevaret.
til det følgende skal du bruge
kalorimeteret modtager energien
100 j/K * temperaturstigningen
vandet modtager
m*c*temperaturstigningen m masse af vand, c vands specifikke varmefylde
damp afgiver
md*L hvor md er dampens masse
Svar #4
25. april 2015 af Heptan
Ahh, nu giver det mening!
Jeg synes dog stadig det er lidt mystisk de skriver hele systemet ... dvs. vanddampen ikke er en del af systemet?
Nå, nu ved jeg ihvertfald at et kalorimeter ikke inkluderer indholdet.
Svar #5
25. april 2015 af Heptan
#3
Hvorfor eksluderer du kalorimeteret?
I a) har jeg brugt tabelværdien for L, og jeg tænker at kalorimeteret er en del af systemet, men at der sker et varmetab til omgivelserne i den virkelige verden.
a) 175,4 kJ
b) 82 g · 2258 J/g = 185,2 kJ
c) (185,2 kJ - 175,4 kJ) / (185,2 kJ) · 100 % = 5,3 %
d) 2139 kJ/kg
Svar #6
25. april 2015 af peter lind
Vanddampen er en del af systemet. Vanddampen afgiver varme til resten af systemet.
Svar #7
25. april 2015 af Heptan
#6
Men vanddampen optager vel så en negativ varme, så hele systemet optager 0 Joules?
Svar #9
25. april 2015 af peter lind
Det kan du godt sige, Jeg vil hellere sige som i #6 at vanddampen afgiver varme til resten af systemet
Skriv et svar til: Fordampningsvarme
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




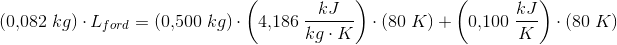
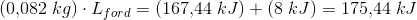
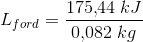
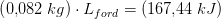
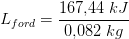
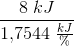

 fortætningsvand á 100°C
fortætningsvand á 100°C