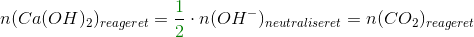Kemi
c) Hvor mange % af den tildelte mængde CO2 har reageret?
Hej
Jeg er i gang med at lave en kemiaflevering, som indeholder følgende opgave, som er vedhæftet.
Jeg har lavet a og b, men jeg mangler c'eren. Er der en som evt. kunne hjælpe mig ?
Svar #2
27. april 2015 af Kemifjols (Slettet)
#1
Godt nok har jeg a'eren sagt - pOH = -log(0,0200), men det er så åbenbart forkert...
Men kan du hjælpe med c'eren? :)
Svar #4
27. april 2015 af Heptan
c)
Da pH >> 7 kan vi se bort fra vands egendissociation. Hermed kan vi altså direkte beregne hvor meget hydroxid der er blevet neutraliseret:
![n(OH^-)_{neutraliseret}=n(OH^-)_{f \o r}-n(OH^-)_{efter} = [OH^-]_{f\o r}\cdot V-n(OH^-)_{efter}](https://media.studieportalen.dk/images/equations/-LKddpEUJE2gxr-BKsyVCw==.gif)
Heraf stofmængden af calciumhydroxid, og dermed stofmængden af carbondioxid, som har reageret:
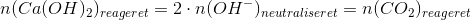
Nu kan udbyttetprocenten let beregnes:
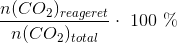
Svar #5
27. april 2015 af Kemifjols (Slettet)
Har jeg så ret i denne besvarelse af c'eren? :)
Svar #6
27. april 2015 af Heptan
#4 Fortsat
Den totale stofmængde af carbondioxid der blev tilledt er:
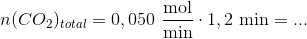
Svar #7
27. april 2015 af Heptan
#4 Korrektionc)
Da pH >> 7 kan vi se bort fra vands egendissociation. Hermed kan vi altså direkte beregne hvor meget hydroxid der er blevet neutraliseret:
Heraf stofmængden af calciumhydroxid, og dermed stofmængden af carbondioxid, som har reageret:
Antallet af % kan nu beregnes:
Svar #8
27. april 2015 af Heptan
#5
Det er korrekt, pas dog på med at afrunde undervejs ... der er tre betydende cifre, så i princippet skal resultatet også angives med tre betydende cifre (jeg ved ikke hvor meget din lærer gør ud af det).
Tilbage er der bare at beregne den forbrugte stofmængde af carbondioxid, den totale stofmængde carbondioxid og så procenten.
Svar #9
27. april 2015 af Kemifjols (Slettet)
Skal jeg så slette min svar og prøve at lave et nyt et med jeres svar ovenover? For kan ikke se, hvordan jeg skal kunne finde den forbrugte stofmængde af carbondioixd, hvis den ikke er den samme, som CaOH2 :)
Svar #10
27. april 2015 af Heptan
Den er bare 12 mmol - 5 mmol = 7 mmol
Da de reagerer i forholdet 1:1 er de netop identiske.
:-)
Svar #12
28. april 2015 af Kemifjols (Slettet)
Lige et spørgsmål til:
Er det ikke forkert at sige 0,0200 M * 0,600 L, når man skal finde stofmængden for Ca(OH)2 før? Burde det ikke være 0,0400 M * 0,600 L?
Skriv et svar til: c) Hvor mange % af den tildelte mængde CO2 har reageret?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










![\left [ OH^- \right ]=2\cdot (0,600\; L)\cdot \left ( 0,0200\; \frac{mol}{L}\right )](https://media.studieportalen.dk/images/equations/AlN07e1Lrhx31MtVw6O2yw==.gif)
![pH=14+\log\left(\left [ OH^- \right ]\right)](https://media.studieportalen.dk/images/equations/Iw40ofQQ4guAUbisrXivVw==.gif)
![[OH^-]_{f\o r}=2\cdot c(Ca(OH)_2)=2\cdot 0,0200 \ \textup{M}=0,0400\ \textup{M}](https://media.studieportalen.dk/images/equations/WBdw3hcnGjT2mOje2YPWeA==.gif)
![pH=14+\log \left ( [OH^-]_{f\o r} \right )](https://media.studieportalen.dk/images/equations/vibEHH5U0EDo4z-I5yymKg==.gif)
![n(OH^-)_{efter}=[OH^-]_{efter}\cdot V=10^{pH-14}\cdot 0,600\ \textup{L}](https://media.studieportalen.dk/images/equations/gce2eXwEHz6vyTRN7ypHfg==.gif)