Kemi
KEMI HJÆLP!! HASTER
Hvad er forskellen på om Cu reagerer med fortyndet syre eller koncentreret syre?
Svar #1
02. maj 2015 af DaenerysTargaryen (Slettet)
Det har noget at gøre med reaktionshastigheden. Kobber vil sandsynligvis næsten ikke reagere i den fortyndede syre, mens den vil reagere hurtigere i den koncentrerede syre.
Svar #2
02. maj 2015 af Soeffi
Se evt.: https://www.youtube.com/watch?v=pJSQq494oV4. Det er kobbers reaktion med HNO3.
Svar #4
02. maj 2015 af mathon
Koncentreret HNO3:
Cu (s) + 4 HNO3 (aq) 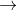 Cu(NO3)2 (aq) + 2 NO2 + 2 H2O (l)
Cu(NO3)2 (aq) + 2 NO2 + 2 H2O (l)
og/eller
Koncentreret HNO3:
Cu (s) + 8 HNO3 (aq) 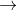 3 Cu(NO3)2 (aq) + 2 NO + 4 H2O (l)
3 Cu(NO3)2 (aq) + 2 NO + 4 H2O (l)
Svar #5
02. maj 2015 af Heptan
#3Fortyndet HNO3:
Cu (s) + 2 HNO3 (aq)
Cu(NO3)2 (aq) + H2 (g)
Hmm, kobber står til højre for H+/H2 i spændingsrækken ...
Svar #6
02. maj 2015 af Soeffi
#0 Hvad er forskellen på om Cu reagerer med fortyndet syre eller koncentreret syre?
Er du sikker på at spørgsmålet går på syrens koncentration. Kan det ikke være: Hvorfor reagerer Cu med salpetersyre og ikke eller dårligt med saltsyre og svovlsyre?
Svar #7
03. maj 2015 af mathon
Korrektion:
I #2 og #3 ville jeg vise forskellen i fortyndet HNO3's virkemåde som "syre" og som "oxiderende syre",
men slap ikke heldigt fra det, som påpeget i #5. Jeg burde NATURLIGVIS have understreget, at
Cu (s) + 2 HNO3 (aq) 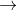 Cu(NO3)2 (aq) + H2 (g) ikke finder sted i virkeligheden
Cu(NO3)2 (aq) + H2 (g) ikke finder sted i virkeligheden
og derfor beklageligvis er mere vild- end vejledende, da Cu står til højre for H i metallernes elektrokemiske spændingsrække.
Skriv et svar til: KEMI HJÆLP!! HASTER
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





