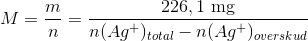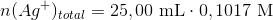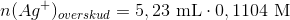Kemi
bromidbestemmelse
07. maj 2015 af
gnidniv (Slettet)
-
Niveau: A-niveau
Er der et klogt hovede, der kan hjælpe mig igennem denne type opgave?
Bromidbestemmelse.
226,1 mg stof opløses i vand. Derpå tilsættes 25,00 ml 0,1017 M sølvnitrat-opløsning i overskud, idet
sølv(I)ionerne danner bundfald med bromid:
Br? + Ag+ ? AgBr(s)
Derefter titreres overskuddet af sølvnitrat med HCl til ækvivalenspunktet, hvor der er tilsat 5,23 ml 0,1104 M HCl: Ag+ + Cl? ? AgCl(s)
Beregn stoffets molære masse på grundlag af bromid-analysen
Bromidbestemmelse.
226,1 mg stof opløses i vand. Derpå tilsættes 25,00 ml 0,1017 M sølvnitrat-opløsning i overskud, idet
sølv(I)ionerne danner bundfald med bromid:
Br? + Ag+ ? AgBr(s)
Derefter titreres overskuddet af sølvnitrat med HCl til ækvivalenspunktet, hvor der er tilsat 5,23 ml 0,1104 M HCl: Ag+ + Cl? ? AgCl(s)
Beregn stoffets molære masse på grundlag af bromid-analysen
Skriv et svar til: bromidbestemmelse
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.