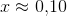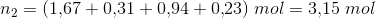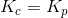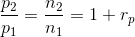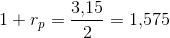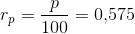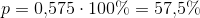Kemi
Kemisk ligevægt
Hej allesammen.
Jeg håber i kan hjælpe mig med følgende opgave.
I en beholder findes en ligevægtsblanding bestående af de i reaktionsskemaet nævnte gasser:
SO2 (g)+NO(g) <-> SO3 (g)+NO(g)
Beholderen indeholder følgende stofmængder:
n(SO2)=0,62 mol n(NO2)=0,41 mol n(SO3)=0,84 mol n(NO)=0,13 mol
a) Beregn en værdi for ligevægtskonstanten ved den pågældende temperatur.
Det har jeg beregnet til Kc= 0,4295
Uden at temperaturen ændres fyldes nu 1,15 mol SO2 (g) i beholderen.
b) Beregn stofmængderne af alle fire gasser i beholderen, når ligevægten atter har indstillet sig.
De nye stofmængder har jeg også beregnet: n(SO2)=1,667 mol n(NO2)=0,307 mol n(SO3)=0,943 mol n(NO)=0,233 mol
c) Hvor mange procent er trykket i beholderen steget fra den første ligevægtssituation til den anden?
Jeg er godt klar over at jeg skal bruge idealgasligningen, men jeg ved ikke helt hvordan?
Tak på forhånd:)
Skriv et svar til: Kemisk ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








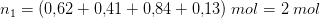
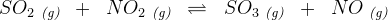
![\frac{\left [0{,}84+x \right ]\cdot \left [0{,}13+x \right ]}{\left [ 0{,}62+1{,}15 -x\right ]\left [ 0{,}41-x \right ]}=0{,}429583\; \; \; \; \; \; 0<x<0{,}41](https://media.studieportalen.dk/images/equations/h3XOemFaNbpMiytAV3Kydg==.gif)