Kemi
Natriumhydrogencarbonat
Hej alle. Jeg har denne opgave som simpelthen driller mig, så vil høre om der er nogle der kan være behjælpelige. Jeg synes virkelig jeg har kigget meget på det, men jeg forstår simpelthen ikke hvad jeg skal hverken i spørgsmål b, c eller d. Håber i kan hjælpe :)
Et glas i kemikaliedepotet er forsynet med en etiket, hvorpå der står Natriumhydrogencarbonat. I forbindelse med et eksperiment bliver man klar over, at glassets indhold er en blanding af natriumhydrogencarbonat og natriumcarbonat. For at finde frem til blandingsforholdet mellem de to stoffer laver man følgende undersøgelse:
Der afvejes 4,80 g af glassets indhold og denne portion opvarmes herefter i en porcelænsdigel til ca. 300 grader i ca. 10 minutter. Under disse omstændigheder omdannnes alt natriumhydrogencarbonat til natriumcarbonat under afvigelsen af carbondioxid.
a) Skriv en reaktionsskema for rekationen.
2NAHCO3 --> Na2CO3 + CO2 + H2O
b) Beregn massen af diglens indhold efter opvarmning under antagelse af, at det oprindelige stof var en natriumhydrogencarbonat.
c) Efter opvarmningen vejer stoffet i diglen 3,85 g.
d) Beregn indholdet af natriumcarbonat i den oprindelige stofblanding, og angiv resultatet i masse %
Svar #1
26. august 2015 af mathon
2 NaHCO3 (s) --> Na2CO3 (s) + CO2 (g) + H2O (g)
ækvivalente mængder 2·84,00 g 106,00 g
4,80 g x
forholdsberegning:
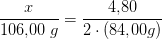
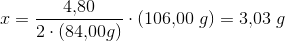
Af de 4,80 g blanding er (3,85 - 3,03) g Na2CO3 uomdannet = 0,82 g Na2CO3.
kortere:
Af de 4,80 g blanding er 0,82 g Na2CO3.
Na2CO3 i pct.
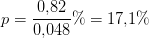
Svar #2
26. august 2015 af serenabb (Slettet)
Men skal det ikke være en ligning med 2 ubekendte hvor 2 NaHCO3 er x og Na2CO3 er y? :)
Svar #3
26. august 2015 af mathon
korrektion:
 g NaHCO3 bliver til
g NaHCO3 bliver til 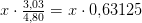 g Na2CO3
g Na2CO3
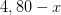 g Na2CO3 forbliver uomdannet
g Na2CO3 forbliver uomdannet
Den samlede mængde Na2CO3 bliver
derfor
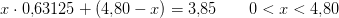
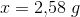 NaHCO3
NaHCO3
Na2CO3 i pct.
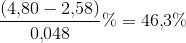
Svar #4
26. august 2015 af Soeffi
#0
a) Skemaet kan skrives:
2 NaHCO3 → Na2CO3 + CO2 + H2O
Før (antal mol) x y 0 0
Efter (antal mol) 0 y + x/2 x/2 x/2
Molmasse af NaHCO3 = 84,0 g/mol.
Molmasse af Na2CO3 = 106 g/mol
b) Det antages at y = 0. Man skal finde massen af Na2CO3 efter reaktionen under den antagelse.
Denne masse er: (106 g/mol)·(x/2).
Her findes x af: x·84,0 g/mol = 4,80 g ⇒ x = 0,0571 mol. Dette giver:
Masse af Na2CO3 = (106 g/mol)·(0,0571mol/2) = 3,03 g.
c) - intet spørgsmål.
d) Det antages at y≠0. Man skal finde forholdet: [(masse af Na2CO3 før reaktion)·100%]/4,80 g =
[y·(106 g/mol)·100%]/4,80 g.
Til at bestemme y har man masseligevægtene:
1) x·84 g/mol + y·106 g/mol = 4,80 g
2) (y + x/2)·106 g/mol = 3,85 g
Disse giver: x = 0.0307 og y = 0.0210 og man får:
Masse-% = [y·(106 g/mol)·100%]/4,80 g = [0.0210·(106 g/mol)·100%]/4,80 g = 46,4%.
-------------
Det kan også beregnes ud fra tallene 4,80 g, 3,03 g og 3,85 g ved hjælp af en forholdstals-betragtning.
Hvis stoffet som udgangspunkt er rent NaHCO3 får man 3,03 g Na2CO3. Hvis stoffet var rent Na2CO3
ville man få 4,80 g Na2CO3. Hvis andelen af Na2CO3 er z og man får 3,85 g Na2CO3 som produkt,
kan z findes af den lineære sammenhæng: (1 - z) · 3,03 g + z · 4,80 g = 3,85 g ⇒ z = 0,464.
Skriv et svar til: Natriumhydrogencarbonat
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


