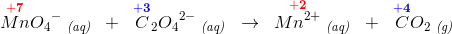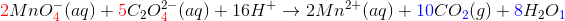Kemi
Redoxreaktion
Nogen, der ville hjælpe mig med redoxreaktion...
Jeg har skrevet reaktionen + afstemt.. ville høre om det er rigtigt?
1 MnO4- (aq) + 5 C2O42- (aq) → 1 Mn2+ (aq) + 5 CO2 (g)
Mn ( 7 → 2) falder med 5
C (3 → 4) = stiger med 1
Jeg kan ikk finde ud af at finde ladningerne? hvordan gør man det...
Svar #2
26. august 2015 af LouiseJense (Slettet)
Det har jeg også gjort... Men, jeg skal jo også skrive det der H+ (syre) og H2O i reaktionen.. Så har vi jo brug for at vide, hvilke ladningerne der er i venstre og højre side og finde forskellen, som vi kan sætte ind foran H.. Forstår du hvad jeg mener? :)
Svar #4
26. august 2015 af mathon
afstemning af op- og nedgange:
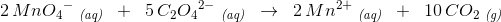
afstemning af ladning:
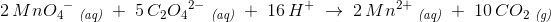
afstemning af hydrogen:
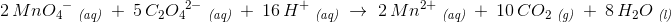
oxyxgen stemmer.
Svar #6
26. august 2015 af LouiseJense (Slettet)
og hvorfor er det 2 foran? Er det ikk
5
1
Mn ( 7 → 2) falder med 5
C (3 → 4) = stiger med 1
Svar #7
26. august 2015 af Soeffi
#0
Husk at nævne, at det er sur opløsning, det er ikke ligegyldigt. Opgang og nedgang er rigtige, men inden du ganger over, så start med at sørge for at der er 1 Mn og 1 C på begge sider:
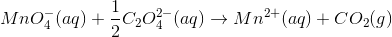
Herefter ganger du med opgang og nedgang:
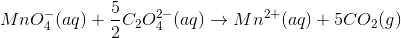
Ladninger afstemmes med H+:
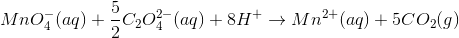
Dernæst afstemmes O med H2O:
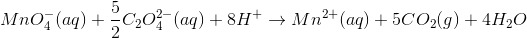
Til sidst ganges igennem med 2 (det kunne også være gjort som trin 2 før afstemning af opgang og nedgang):
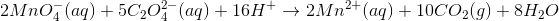
Svar #8
26. august 2015 af mathon
I sur væske skal ladningen afstemmes med 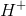
Der er 12 negative ladninger på venstre side og 4 positive ladninger på højre side.
Tilføjelse af 16 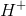 afstemmer ladningen.
afstemmer ladningen.
Nu er der 16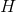 på venstre side og ingen
på venstre side og ingen 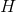 på højre side.
på højre side.
Tilføjelsen af 8 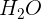 på høje side afstemmer hydrogen.
på høje side afstemmer hydrogen.
Da 1 molekyle 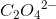 indeholder
indeholder 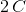 er det mere praktisk med
er det mere praktisk med
Mn 2
C 10
Svar #9
26. august 2015 af LouiseJense (Slettet)
Jeg forstår det godt nogenlunde nu... men, hvordan kom du frem til 12 negative ladning på venstre side og 4 positive på højre side.. kan du måske vise en udregning eller sådan noget
Svar #10
26. august 2015 af mathon
Almindeligvis afstemmer man hydrogen med 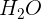
og kontrollerer til sidst, at oxygen passer.
Svar #12
26. august 2015 af LouiseJense (Slettet)
Stemmer det, at vi sætter 8 foran H_2O, der er jo flere oxygen på den ene side end på den anden?
Svar #13
26. august 2015 af Soeffi
#12. Med hensyn til ilt får du:
Venstre: 2·4 + 5·4 = 28Højre: 10·2 + 8·1 = 28
Svar #14
26. august 2015 af LouiseJense (Slettet)
Jeg forstår stadig ikk, hvordan i får 2 foran Mn, 5 foran C_2 , 2 foran Mn og 10 foran CO_2 ?
er vi ikk enige om, at
Mn ( 7 → 2) falder med 5
C (3 → 4) = stiger med 1
så er det vel 1 foran Mn, 5 foan C_2, 1 foran Mn og 5 foran CO_2 ?
Svar #15
26. august 2015 af LouiseJense (Slettet)
Jeg har forstået det nu... tusind tak for alle jeres hjælp :) Det var sødt af jer
Skriv et svar til: Redoxreaktion
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.