Kemi
molmasse?
Hej, er der nogen som gider at forklare mig denne opgave?
10 g ikke elektrolyt vil, når den er opløst i 500 g vand, giver anledning til en frysepunktssænkning på 0,372 grader celcius. Opløsningens massefylde sættes til 1 g/ mL.
Beregn den opløste forbindelse molmasse?
Svar #1
30. august 2015 af mathon
Sammenhængen er
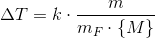
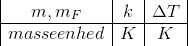
hvor
 er frysepunktssænkningen
er frysepunktssænkningen
 er massen af det oplsøste stof
er massen af det oplsøste stof
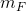 er massen af det Flydende opløsningsmiddel
er massen af det Flydende opløsningsmiddel
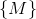 er det opløste stofs molmassetal
er det opløste stofs molmassetal
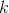 er en proportionalitetsfaktor (kryoskopiske konstant)
er en proportionalitetsfaktor (kryoskopiske konstant)
Når vand er opløsningsmidlet
gælder:
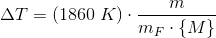
Svar #2
30. august 2015 af karenvivild (Slettet)
Tak skal du have for hjælpen. Jeg har fået svaret til at være 100 g/ mol.
I klassen har vores kemilærer kun givet os denne formel, til at løse opgaven:
ΔTf=Kf * (cm2+cm3...+)
, hvor ΔTf= frysepunktssænkning
Kf= en konstant for vand 1, 853 K mol-1*kg
cm= osmolalitet af det(evt, flere) opløste stoffer.
Jeg har forsøgt at anvende denne formel for at komme frem til værdien i facitlisten, men det ser ud som om, at den ikke virker?
Mit spørgsmål er, om din ovenstående formel er den eneste måde, man kan beregne molmassen af det opløste stof?
Skriv et svar til: molmasse?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

