Kemi
Ligevægte og ligevægtskonstant ift. gibbs energi
Jeg har et spørgsmål omkring definitionen af ligevægtskonstanten ift ligevægt og gibbs energi
når G=0 så er Kc=1
men hvad betyder det hvis at Kc= 8? Så skulle der jo blive dannet mere produkt, men så er den vil ikke i ligevægt?
Så er en kemisk reaktion kun i ligevægt hvis Kc = 1?
Svar #2
10. september 2015 af 282726 (Slettet)
ved en anden temperatur?
Jeg forstår bare ikke når man siger at når G = 0 så er Kc = 1
hvad betyder det så når en reaktion har en Kc der er forskellig fra en?
Fx hvis man siger at Kc = 8, så er der mere produkt, men hvorfor siger man så stadig at reaktionen er i ligevægt, hvis forholdet mellem produkt og reaktant ikke er 1
Svar #3
11. september 2015 af mathon
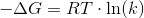
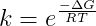
Når 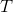 ændres, ændres
ændres, ændres 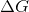 og
og 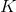 .
.
Ligevægt betyder, at i
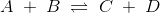 (eller hvordan reaktionen nu ser ud)
(eller hvordan reaktionen nu ser ud)
er
![-\frac{\mathrm{d} \left [ A \right ]}{\mathrm{d} t}=\frac{\mathrm{d} [C]}{\mathrm{d}t}=\frac{\mathrm{d} [D]}{\mathrm{d}t}](https://media.studieportalen.dk/images/equations/lGlj6LsUTtQLDSsCE3lChA==.gif)
dvs en tilstand, hvor
antal reaktantmolekyler til produktmolekyler = antal produktmolekyler til reaktantmolekyler
men det betyder ikke, at ligevægtsbrøken er lig med 1.
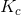 og
og 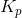 er temperaturafhængige og har yderst sjældent værdien 1.
er temperaturafhængige og har yderst sjældent værdien 1.
Skriv et svar til: Ligevægte og ligevægtskonstant ift. gibbs energi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





