Kemi
Udregn opløselighed og bundfald
Har lidt problemer med at forstå, hvordan følgende opgave skal løse. På forhånd tak for hjælpen.
Molmassen for mangan(II)chlorid (MnCl2) er 125,84 g·mol–1
Molmassen for natriumhydroxid (NaOH) er 40,00 g·mol–1
Opløselighedsproduktet for mangan(II)hydroxid (Mn(OH)2) er Ksp = 2,54·10–13 M3 ved 25°C.
I en flaske opløses 0,50 g mangan(II)chlorid i 50,0 mL vand. I en anden flaske opløses 0,50 g
natriumhydroxid i 50,0 mL vand. Indholdet i de to flasker blandes sammen og fortyndes op til
et total volumen på 5,00 L.
Vis ved beregning om der kommer bundfald.
Som en del af besvarelsen skal reaktionsligningen for den eventuelle fældning af
mangan(II)hydroxid samt det tilhørende udtryk for opløselighedsproduktet opskrives.
Svar #1
10. oktober 2015 af mathon
Opløsning af MnCl2:
![\left [ Mn^{2+} \right ]=\left [ MnCl_2 \right ]=\frac{\frac{0{,}50\; g}{125{,}84\; \frac{g}{mol}}}{0{,}050\; L}=0{,}079466\; M](https://media.studieportalen.dk/images/equations/Uv9wlGx1RJw8KiEH6UaU1w==.gif)
Opløsning af MnCl:
![\left [ OH^- \right ]=\left [ NaOH \right ]=\frac{\frac{0{,}50\; g}{40{,}00\; \frac{g}{mol}}}{0{,}050\; L}=0{,}2500\; M](https://media.studieportalen.dk/images/equations/Kj0Wrn2qaTeKGyQiyxQK-Q==.gif)
Blanding:
![\left [ Mn^{2+} \right ]=\frac{0{,}079466\; M}{100}=7{,}9466\cdot 10^{-4}\; M](https://media.studieportalen.dk/images/equations/rz3KDLsMTMLDQ6FbN-sbxA==.gif)
![\left [ OH^- \right ]=\frac{0{,}2500\; M}{100}=2{,}5\cdot 10^{-3}\; M](https://media.studieportalen.dk/images/equations/EzNhBRKSMVcO3kOG0tvWEQ==.gif)
Ionproduktet: for Mn(OH)2:
![\! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \left [ Mn^{2+} \right ]\cdot \left [ OH^- \right ]^2=\left ( 7{,}9466\cdot 10^{-4}\; M \right ) \right ]\cdot \left (2{,}5\cdot 10^{-3}\; M \right )^2=4{,}96662\cdot 10^{-9}\; M^3>2{,}54\cdot 10^{-13}\; M^3](https://media.studieportalen.dk/images/equations/U0mMWSNy2jCCWrASu-9B7w==.gif)
hvorfor der udfældes Mn(OH)2:
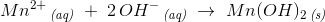
Opløselighedsduktet: for Mn(OH)2:
![\left [ Mn^{2+} \right ]\cdot \left [ OH^- \right ]^2=2{,}54\cdot 10^{-13}\; M^3](https://media.studieportalen.dk/images/equations/asKKAxNdVvSjhxYq2jwuYg==.gif)
Svar #3
13. oktober 2017 af P0607 (Slettet)
Hvorfor divideres der med 100, når de to opløsninger blandes?
Skriv et svar til: Udregn opløselighed og bundfald
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




