Kemi
hjælp til forståelse
det er ikke fordi at det haster, men jeg mangler bare at kunne forstå noget i en opgave. opgaven er som følger:
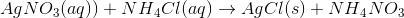
31.2 ml 0.5M AgNO3 sættes til 31 ml 0.3M NH4Cl. hvor mange gram AgCl dannes?
jeg har fået at stofmængden atf henholdsvist AgNO3=0.0156 mol og NH4Cl=0.0093 mol. jeg har så fået molarmassen af AgCl=143,3209 g/mol.
mit problem er at ifølge opgaven skal massen af den dannede AgCl give 3,23 g, men det får jeg ikke. hvad gør jeg galt ? umiddelbart ville jeg sige at jeg skulle bruge stofmængden af NH4Cl til at finde massen af AgCl, da det er den mindste stofmængde i reaktionen. men ingen af stofmængderne giver det rigtige svar. så hvad skal jeg gøre ?
Svar #1
24. november 2015 af onewingedweeman (Slettet)
OBS!!!!!!
jeg havde lavet en observationsfejl.
det skulle ikke give 3.23g men 1.33g. det kan jeg tilgengæld godt få, så jeg har løst denne opgave.
undskyld for ulejligheden.
Skriv et svar til: hjælp til forståelse
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







