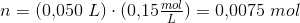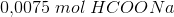Kemi
puffer forståelse
jeg har et spørgsmål, hvor jeg gerne vil vide, hvordan det giver det givne resultat. opgaven er:
50 ml opløsning af 0,15 M myresyre titreres med 0,15 M NaOH
pK a for myresyre er 3,75.
Hvad er pH efter tilsætning af 50 ml 0,15 M NaOH ?
resultatet er 8,31. men jeg kan bare ikke se, hvordan det giver det resultat. jeg kender godt pufferligningen, men hvordan giver det ph=8.31 ?
Svar #1
28. november 2015 af mathon
Ved 25°C:
50 ml opløsning af 0,15 M myresyre tilsat 50 mL 0,15 M NaOH er
100 mL 0,0075 mol HCOONa dvs
100 mL 0,075 M HCOO-
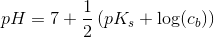
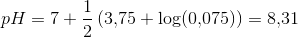
Svar #3
28. november 2015 af onewingedweeman (Slettet)
#1Ved 25°C:
50 ml opløsning af 0,15 M myresyre tilsat 50 mL 0,15 M NaOH er
100 mL 0,0075 mol HCOONa dvs
100 mL 0,075 M HCOO-
hvordan fik du 0,0075 mol HCOONa ?
Svar #4
28. november 2015 af onewingedweeman (Slettet)
#1Ved 25°C:
50 ml opløsning af 0,15 M myresyre tilsat 50 mL 0,15 M NaOH er
100 mL 0,0075 mol HCOONa dvs
100 mL 0,075 M HCOO-
og hvor har du fået 7 fra ?
Svar #6
28. november 2015 af onewingedweeman (Slettet)
okay, men hvordan kom du frem til:
100 mL 0,0075 mol HCOONa dvs
100 mL 0,075 M HCOO-
Skriv et svar til: puffer forståelse
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








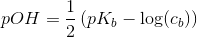
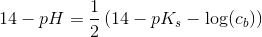
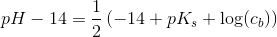
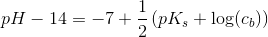
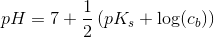
![\left [HCOONa \right ]=\frac{n}{V}=\frac{0{,}0075\; mol}{0{,}100\; L}=0{,}075\; M](https://media.studieportalen.dk/images/equations/NrREOtrO1A3sBTYkX-0PMg==.gif)