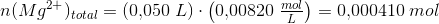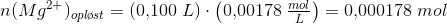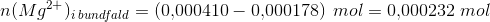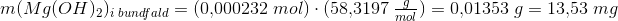Kemi
Koncentrationsbestemmelse
50,0 mL 0,00820 M MgCl2 blandes med 50,0 mL NAOH-opløsning ved 25 grader. Der udfældes et bundfald. Bundfaldet frafiltrereres og den aktuelle koncentration af Mg 2+ i filtratet bestemmes til at være 0,00178 M.
Spørgsmål:
1. Beregn den aktuelle koncentration af OH- i filtratet
2. Beregn massen af de udfældede bundfald
Svar #3
29. november 2015 af Kemifjols (Slettet)
Hvordan finder jeg så massen af det udfældet bundfald?
Skal jeg først finde stofmængden? Og derefter m ved n*M
Skriv et svar til: Koncentrationsbestemmelse
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![\left [ Mg^{2+} \right ]\cdot \left [ OH^{-} \right ]^2=K_{sb}=5\cdot 10^{-12}\; M^3](https://media.studieportalen.dk/images/equations/tuxmb6VKYt6bPlNxOcZeIw==.gif)
![\left [ OH^{-} \right ]=\left ( \frac{5\cdot 10^{-12}\; M^3}{\left [ Mg^{2+} \right ]}\right )^{\frac{1}{2}}](https://media.studieportalen.dk/images/equations/mLS6yNZwO08FZ-m9kC2d_w==.gif)