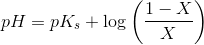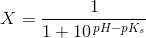Kemi
Puffersystem
Er der en som kan forklare mig hvordan man kan forklare de forskellige formler indenfor puffersystemer og hvad man bruger dem til?
Svar #1
10. februar 2016 af mathon
En puffer er et korresponderende svag syre-svag base system.
For et monoprot system gælder:
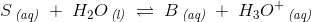
med ligevægtsbrøken:
![\frac{\left [ B \right ]\cdot \left [ H_3O^+ \right ]}{\left [ S \right ]}=K_s](https://media.studieportalen.dk/images/equations/ZhNLaAE0G5AJopCOt8pLCw==.gif)
![\left [ H_3O^+ \right ]\cdot \frac{\left [ B \right ]}{\left [ S \right ]}=K_s](https://media.studieportalen.dk/images/equations/LX7R8vLUkUaGzmgzKIR3rg==.gif) som logaritmeret
som logaritmeret
giver talværdiligningen:
![\log\left (\left [ H_3O^+ \right ] \right )+ \log\left (\frac{\left [ B \right ]}{\left [ S \right ]} \right )=\log\left (K_s \right )](https://media.studieportalen.dk/images/equations/Z8QILri88EiwmEYhtPn8OQ==.gif) multipliceres m. -1
multipliceres m. -1
![-\log\left (\left [ H_3O^+ \right ] \right )- \log\left (\frac{\left [ B \right ]}{\left [ S \right ]} \right )=-\log\left (K_s \right )](https://media.studieportalen.dk/images/equations/nI21NcDRL80L9A5tuQ2nCQ==.gif)
![pH- \log\left (\frac{\left [ B \right ]}{\left [ S \right ]} \right )=pK_s](https://media.studieportalen.dk/images/equations/VvyhfU9QSTy3aeO5BdCsog==.gif)
![pH=pK_s+\log\left (\frac{\left [ B \right ]}{\left [ S \right ]} \right )](https://media.studieportalen.dk/images/equations/uhVcWRzH2rTNAByTDSFM4Q==.gif)
hvoraf
![\frac{\left [ B \right ]}{\left [ S \right ]}=10^{pH-pK_s}](https://media.studieportalen.dk/images/equations/6W6zvcJflwkHxdoJSRfIyQ==.gif)
Skriv et svar til: Puffersystem
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


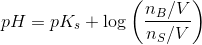
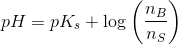
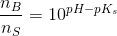
![c=\left [ B \right ]+\left [ S \right ]](https://media.studieportalen.dk/images/equations/chMRsfJc16VJraUpS_NsJg==.gif)
![\left [ B \right ]=\alpha \cdot c](https://media.studieportalen.dk/images/equations/vJS4siQlM7BsMH3O8P3XMA==.gif) og
og ![\left [ S \right ]=\left (1-\alpha \right )\cdot c](https://media.studieportalen.dk/images/equations/rxFVooSpqaoDJqW7HEb6IA==.gif) hvor
hvor 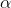 er ioniseringsgraden/dissociationsgraden.
er ioniseringsgraden/dissociationsgraden.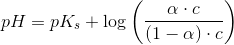
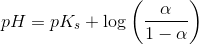
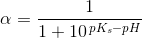
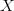
![\left [ B \right ]=(1-X) \cdot c](https://media.studieportalen.dk/images/equations/SpgBKRBTqamq1dIDrBBbjQ==.gif) og
og ![\left [ S \right ]=\left X\cdot c](https://media.studieportalen.dk/images/equations/7aROlor2WEmKwxXaCiMhDg==.gif)