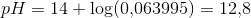Kemi
Tilsætte syre til en bufferopløsning
Jeg har udregnet pH i en buffer, der består af [H2PO4-]=6,2mM og [HPO4-2]=3,8mM til at være omkring 7. Her har jeg brugt bufferligningen og pKa for H2PO4- som er 7,21.
I den efterfølgende opgave skal jeg dog have hjælp. Der står, at der tilsættes 1 dråbe 0,1M HCl opløsning til 1 dL af bufferopløsningen. Hvad bliver pH?
Det skal lige siges, at 1 dråbe svarer til 0,00005L
Hvad bliver pH, hvis bufferopløsningen fortyndes 10 gange?
Jeg vil meget gerne have fremgangsmåden med også! :-)
På forhånd tak!
Svar #1
18. februar 2016 af mathon
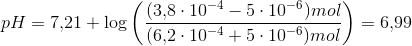
I fuld overnesstemmelse med, at en buffer - med en rimelig kapacitet - er et korresponderende svagt syre-base-system, hvis pH-værdi ikke ændres mærkbart selv ved tilsætning af et mindre volumen stærk syre eller stærk base.
Skriv et svar til: Tilsætte syre til en bufferopløsning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




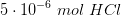 er indholdet reduceret til
er indholdet reduceret til 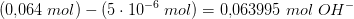
![pH=14-pOH=14+\log\left(\left [ OH^- \right ]/M\right)](https://media.studieportalen.dk/images/equations/5af20wR3RCwR31YbIpshig==.gif)