Kemi
pH spørgsmål
Hej jeg har forsøgt at udregne følgende opgaver men kan ikke få det rigtige svar :/
Opgave 1 lyder:
Til 100 ml opløsning af 1 M eddikesyre (CH3COOH) tilsættes 4 g natriumacetat (CH3COONa).
Hvad bliver pH af den resulterende opløsning ?
Det kan antages, at volumen forbliver uændret (100 ml) og, at pKa for eddikesyre er 4,76
---
Jeg tænker at jeg skal bruge pufferligningen, og derfor behøver at udregne n(acetat):
Først udregnes masse% for hvv acetat og natrium:
M(acetat) =59,05 g/mol, M (natrium) = 23,00 g/mol
23/59,05 x 100% = 38,95 %
Dvs at Na udgør 38,95 % af de 4 gram = 1,55 g
Altså har vi 4g - 1,55g = 2,45 g acetat, som omregnes til:
2,45 g / 59,05g/mol = 0,0415 mol acetat
og vi har:
0,1 L x 1M eddikesyre = 0,1 mol eddikesyre
Herefter bruges puffer ligningen: 4,76 + log(0,0415mol/0,1mol) = 4,38 = pH
Men dette tal er ikke korrekt iflg svarmulighederne :/ hvad gør jeg forkert?
Svar #1
25. april 2016 af MN88
Spørgsmål 2 lyder:
Der startes med et bægerglas med 125 ml eddikesyre-acetat buffer med pH=5,00 og total koncentration af buffer 0,100 M.
Der regnes med et pKa=4,76 og d er tilsættes nu 6,30 ml 0,320 M HCl.
Hvad er pH efter tilsætning af syren ?
--------
Her er jeg lidt på bar bund, hvordan udregnes ovenstående?
Svar #2
26. april 2016 af Heptan
1) Du behøver ikke at regne med masseprocenter. Stofmængden af acetat er lig med stofmængden af natriumacetat, så det er meget nemmere bare at beregne 4 g/82,05 g/mol = 0,0488 mol.
Vi får ikke det samme, da du har beregnet masseprocenten i forhold til de 59,05 g/mol, men natriumacetat har molarmassen 82,05 g/mol.
2) Du kan regne med at de 6,30 mL 0,320 M HCl reagerer fuldstændigt med acetat og omdanner en stofmængde af acetat til eddikesyre. Dvs. der omdannes en mængde acetat og der dannes en mængde eddikesyre. Glem ikke at der måske bliver acetat til overs, og at der var eddikesyre i forvejen. Prøv at skrive pufferligningen op efter tilsætning af syren.
Hvis det er uoverskueligt kan du opskrive et før/efter skema hvor du redegør for stofmængderne. Du kan også starte med at skrive matematiske udtryk for stofmængderne efter tilsætning af syre for hver af stofferne.
Svar #3
28. april 2016 af MN88
Mht opg 2, for at skrive pufferligningen op skal jeg kende koncentrationerne af hhv syre og base inden HCl tilføjes; hvordan udregnes disse?
Svar #4
28. april 2016 af Heptan
Brug pufferligningen og udnyt at ca + cb = 0,100 M
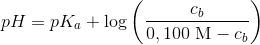
Når du har isoleret og beregnet cb kan du indsætte i ca + cb = 0,100 M for at finde ca.
Du kan med fordel benytte stofmængder efter du har beregnet koncentrationerne.
Svar #5
28. april 2016 af MN88
Genialt :P
Cb = 0,063 M, Ca = 0,037 M
n(b) = 7,875mmol, n(s) = 4,625 mmol, n(H+) = 2,016mmol
efter tilsætning af HCL bliver
n(s) = (4,625 + 2,016)mmol = 6,641 mmol
?n(b) = (7,875 - 2,016)mmol = 5,859 mmol
dermed bliver pH = 4,76 + log(5,859 mmol / 6,641 mmol) = 4,71 hvilket er det korrekte svar :P
Heptan, med >4k forumindlæg har du nærmest opnået legendarisk status her på studieportalen, gad vide hvor mange farmaceuter, læger og ingeniører du har været med til at skabe :P jeg tager hatten af for dit arbejde herinde og tilbyder gerne en mindre donation som symbol på min taknmemelighed :) skriv hvis det har interesse.
Mvh MN88
Skriv et svar til: pH spørgsmål
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








