Kemi
Spørgsmål til reduktion af kaliumpermanganat
Jeg har nogle spørgsmål til et forsøg hvor man reducere kaliumpermanganat
Først har vi et reagensglas med kaliumpermanganat, hvortil vi tilsætter noget NaOH for at ændre PH
1. Hvorfor vil vi ændre PH i opløsningen? jeg kan ikke finde noget om dette
Derefter tilsætter vi noget natriumdisulfit som ændre farven af opøsningen til grøn. Dette er fordi So3 2-, reducere MnO4- til MnO4 2-.
2. Hvor kommer So3 2- fra? kommer det fra natriumdisulfit
Herefter tilsætter vi dråbevis HCL, som gør at der kommer brunt bundfald. Detter er igen fordi so3 2- er inde og reducere MnO4 2-
3. Hvad har HCL med denne reaktion at gøre, hvorfor reducere so3- først MnO4 2- nu og ikke før HCL blev tilsat?
Nu tilsætter mere HCl hvorved opløsningen blier farveløs igen fordi so3- er inde og reducere.
-------------------------------
Jeg forstår godt redoxreaktionerne, men jeg forstår ikke hvorfor vi skal ændre PH i starten, og hvilken indvirkning HCL har på det hele, selvom den ikke indegår i reaktionerne. Har det noget med lavere PH = mere redox reaktion?
Svar #1
27. maj 2016 af mathon
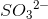 er sulfit-ion
er sulfit-ion
så der er nok tale om dinatriumsulfit 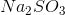 .
.
Du skriver intet om øvelsens formål.
Svar #2
28. maj 2016 af mathon
yderste skal
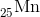
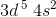 5 uparrede elektroner
5 uparrede elektroner
…
Reduktion af
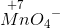 i stærk syre vil gå helt til
i stærk syre vil gå helt til 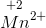 .
.
Den kan kan bringes til at gå trinvis gennem iltningstrinene
på følgende måde:
Lidt 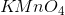 udtrækkes i et reagensglas med demi-vand til en passende vin-rød farve. En tablet NaOH bringes ned i reagensglasset og dernæst en krystal
udtrækkes i et reagensglas med demi-vand til en passende vin-rød farve. En tablet NaOH bringes ned i reagensglasset og dernæst en krystal 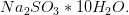
Efter svag omrøring bliver opløsningen stærkt grøn.
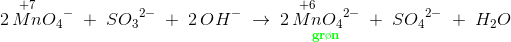
Efter kort tids henstand bliver reaktionsblandingen grumset og nærmest grønbrun:
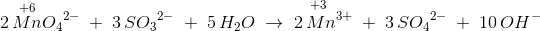
Sætter man nu stærk syre til reaktionsblandingen, bliver indholdet farveløst:
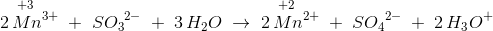
Herved får man "præsenteret" 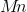 i fire forskellige oxidationstrin,
i fire forskellige oxidationstrin,
hvilket formentlig var øvelsens formål.
Skriv et svar til: Spørgsmål til reduktion af kaliumpermanganat
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








