Kemi
Redoxreaktion
Jeg skal afstemme denne redoxreaktion:
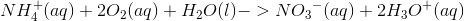
Er det rigtigt at:
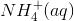 oxidationstal er N= -3
oxidationstal er N= -3
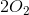 oxidationstal er O = 0
oxidationstal er O = 0
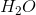 oxidationstal er H = +2 og O = -2
oxidationstal er H = +2 og O = -2
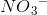 oxidationstal er N = +5
oxidationstal er N = +5
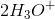 oxidationstal er H = +3 og O = - 2
oxidationstal er H = +3 og O = - 2
N bliver oxideret fra -3 til +5
O bliver reduceret fra 0 til -6
H bliver oxideret fra +2 til +3
Er det rigtigt, eller jeg har regnet forkert
Tak på forhånd :)
Svar #2
29. maj 2016 af 17P (Slettet)
Hvorfra bliver O reduceret fra 0 til -2. Er det fra O2 og H3O+?
Hvorfor skal H ikke tages med?
Skriv et svar til: Redoxreaktion
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


